世界初、窒素原子の自由な付け替えが可能に! ~より安全・シンプルに。創薬や機能性材料開発に貢献~
News&Topics
カテゴリ:プレスリリース|2025年7月18日掲載
九州大学/名古屋工業大学
ポイント
〇 アミンは医薬品などに広く含まれる基本構造だが、特にかさ高いアミンの脱アミノ化は困難であり、新しい変換手法の確立が求められていた。
〇 本研究では、かさ高いα-三級アミンから、触媒を用いてジアゼン(※1)を1段階で合成する手法を世界で初めて開発した。得られたジアゼンを利用し、多様な結合変換を伴う脱アミノ化反応も実現した。
〇 本手法により、アミンを起点とした自在な分子変換が可能となり、創薬や機能性材料開発に貢献する次世代の合成基盤として期待される。
概要
アミンは、医薬品や天然物などの生物活性分子に広く含まれる基本構造であり、分子設計や創薬研究において重要な役割を担ってきました。中でも脂肪族アミンは、長年にわたり有機合成における出発物質として活用されてきましたが、アミノ基(-NH₂)を他の官能基へと置き換える「脱アミノ化反応」の開発は依然として困難であり、特にα位にかさ高い置換基を有するα-三級アミンに対する直接的な変換法は確立されていませんでした。
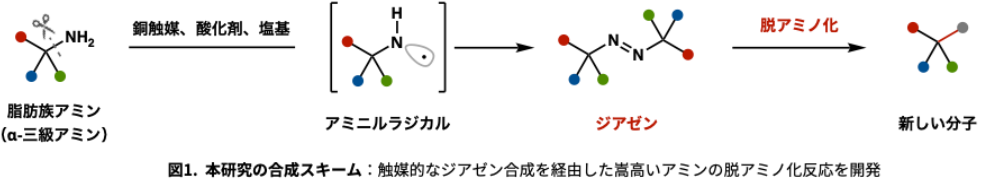
本研究では、こうした課題を克服するため、かさ高いα-三級アミンから化学的にユニークな中間体である「ジアゼン」(N=N結合を有する化合物)を、直接かつ触媒的に1段階で合成する新手法の開発に世界で初めて成功しました。これにより、α-三級アミンを出発点とする脱アミノ化変換の新たな合成基盤が確立されました。
九州大学大学院薬学府の辻汰朗大学院生(研究当時)、福元良空大学院生、針尾たから大学院生、薬学研究院の大澤歩講師、大嶋孝志主幹教授、高等研究院の矢崎亮准教授と、名古屋工業大学生命・応用化学類の林幹大助教らの研究グループによって実施されました。本研究グループは、金属触媒・酸化剤・塩基を組み合わせることで、従来のような有害試薬や多段階操作を必要とせずに、立体的にかさ高いアミンからジアゼンを温和な条件下で迅速に合成する触媒反応の開発に成功しました(図1)。さらに、得られたジアゼンは、熱や光などの穏やかな条件で窒素分子(N₂)を放出し、アルキルラジカルを生成する性質を持ちます。このラジカル中間体を活用することで、炭素―窒素結合を炭素―ハロゲン、炭素―酸素、炭素―炭素など多様な結合へと自在に変換する脱アミノ化ラジカル反応が展開可能であることが明らかとなりました。また、反応機構の解析により、これまで利用例の少なかった脂肪族アミン由来のアミニルラジカル種が反応中に生成していることが示唆されました。これにより、アミニルラジカルを活用した多様な分子変換の可能性が今後さらに広がると期待されます。
今回開発されたジアゼン合成法と、続く脱アミノ化反応により、従来は困難とされていた構造変換がアミンを出発点として簡便に実現可能となりました。これにより、創薬研究におけるリード化合物の迅速な構造最適化や、新素材開発における高機能分子の設計など、幅広い分野での応用が期待されます。本成果は、アミンを有機合成の資源として最大限に活用する次世代の分子変換基盤技術として、今後の有機合成化学の発展に寄与するものです。
本研究成果は、英国の科学雑誌「Nature Communications」に2025年7月7日(月)に掲載されました。
研究の背景と経緯
アミンは、医薬品や天然物などの生物活性分子に広く含まれる基本構造であり、分子設計や創薬研究において長年にわたり中核的な役割を果たしてきました。中でも脂肪族アミンは、合成化学における出発物質として広く用いられています。しかし、アミンを起点として分子の骨格を自在に変換する「脱アミノ化反応」は、依然として大きな課題となっています。とくに、α位にかさ高い置換基を持つα-三級アミンに対しては、立体障害の影響のため既存の変換法では適用が困難でした。さらに、アミンは高い塩基性を示すため、金属触媒の活性を阻害する場合が多く、触媒的な手法の開発が大きく制限されてきました。
このように、アミンの高い供給性・構造多様性という利点を活かしつつ、機能変換を実現する触媒的かつ汎用的な脱アミノ化手法の確立は、有機合成化学・創薬・材料開発の分野における喫緊の課題でした。
研究の内容と成果
本研究では、かさ高いα-三級アミンからジアゼンを、金属触媒・酸化剤・塩基を組み合わせて1段階で合成する触媒的反応手法の開発に、世界で初めて成功しました。従来法では、ジアゼンの合成には多段階や爆発性試薬が必要とされていましたが、本手法では温和な条件下で、迅速かつ高効率にジアゼンを得ることが可能です(図2)。さらに構造の異なるアミンを、それぞれの当量比を調整することで、異なる置換基を有するジアゼンの合成にも成功しました。
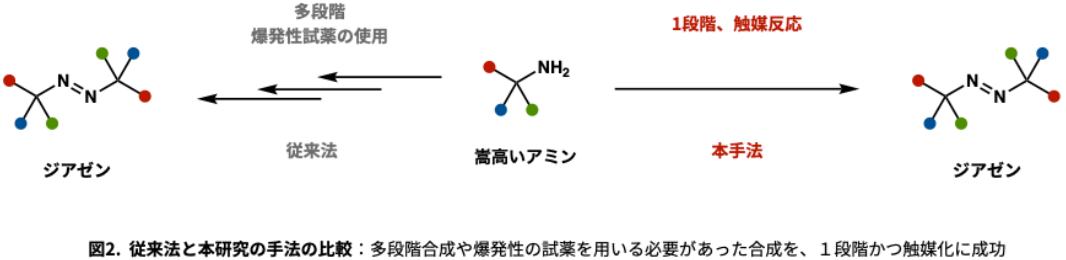
得られたジアゼンは、熱や光などの穏やかな刺激で窒素分子(N₂)を放出し、アルキルラジカルを生成するラジカル前駆体として機能します。これにより、アミンから炭素―ハロゲン、炭素―酸素、炭素―炭素などの多様な官能基へと変換可能な脱アミノ反応が実現しました(図3)。さらに、本反応はFmoc固相ペプチド合成にも応用可能であり、ジアゼンペプチドの合成にも成功しています。
加えて、反応機構解析により、これまで活用例の少なかった脂肪族アミン由来のアミニルラジカル種が反応中に生成していることが示唆され、今後この種のラジカルを利用した分子変換反応の展開にも期待が高まっています。

今後の展開
本研究で開発された触媒的ジアゼン合成法は、アミンという豊富で構造多様性に富む原料から出発して、多様な官能基変換を可能にする新しい分子変換プラットフォームとして、極めて高い汎用性を有しています。これにより、創薬研究におけるリード化合物の迅速な構造最適化や、新素材の高機能化設計といった応用が加速されると期待されます。
今後は、アミニルラジカルを活用した新反応の開発、より複雑な分子群への展開、ペプチドや高分子材料への応用といった多方面への波及が見込まれており、本成果は次世代の分子編集技術として、有機合成化学の発展に大きく貢献するものです。
用語解説
(※1) ジアゼン
2つの窒素原子が二重結合で結ばれた化合物。加熱や光照射で窒素を放出しながら炭素ラジカルを生成できるため、ポリマーのラジカル開始剤として用いられている。
謝辞
本研究はJST 創発的研究支援事業(JPMJFR2229)、JSPS科研費 (JP24H01777, JP21A204, JP21H05207, JP21H05208JP)、AMED 創薬支援推進事(JP21ak0101167, JP22ak0101167, JP23ak0101167)、長瀬科学技術振興財団(代表:大嶋孝志)、武田科学振興財団、野口研究所、中谷財団、新化学技術推進協会(代表:矢崎亮)の助成を受けたものです。
論文情報
掲載誌:Nature Communications
タイトル:Catalytic Diazene Synthesis from Sterically Hindered Amines for Deaminative Functionalization
著者名:Taro Tsuji, Isora Fukumoto, Takara Hario, Mikihiro Hayashi, Ayumi Osawa, Takashi Ohshima, Ryo Yazaki
DOI:10.1038/s41467-025-61662-9
お問い合わせ先
研究に関すること
九州大学 高等研究院
准教授 矢崎亮(ヤザキリョウ)
TEL:092-642-6669
Mail:yazaki[at]phar.kyushu-u.ac.jp
名古屋工業大学 生命・応用化学類
助教 林幹大(ハヤシミキヒロ)
TEL:052-735-7159
E-mail:hayashi.mikihiro[at]nitech.ac.jp
広報に関すること
九州大学 広報課
TEL:092-802-2130
FAX:092-802-2139
Mail:koho[at]jimu.kyushu-u.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
E-mail:pr[at]adm.nitech.ac.jp
*それぞれ[at]を@に置換してください。
ヒメダイヤの新たな応用―蛍光X線ホログラフィーの高圧下での測定に成功 ~特定元素周りの原子位置の3次元的可視化~ 硫化物系電池材料の特性を巡る長年の謎を解明―規則・不規則構造の硫化物系材料の充放電反応機構の詳細解析―

