人工合成分子を結合させた視物質によるユニークな光異性化反応を利用したシグナル伝達機構を解明!~網膜疾患の治療薬開発への期待~
News&Topics
カテゴリ:プレスリリース|2017年3月17日掲載
大学院工学研究科生命・応用化学専攻の片山耕大助教らの研究チームは、人工合成分子を結合させた視物質が大変ユニークな光異性化反応を利用したシグナル伝達を行うことを様々な生物物理学的手法を駆使した構造―機能相関解析から明らかにしました。片山助教が日本学術振興会海外特別研究員として米国オハイオ州ケースウエスタンリザーブ大学・Palczewski教授の研究室に所属していた時に行った研究であり、本成果は米国の権威ある科学アカデミー紀要Proc. Natl. Acad. Sci. USA誌の電子版に3月13日(日本時間3月14日午前5時)号に掲載されました。片山助教はPalczewski教授とともに責任著者として本研究に関わっています。
~視覚が生じるしくみ~ 明暗視を担う光受容タンパク質
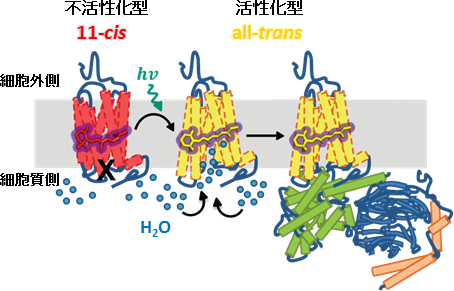
「暗闇で眼が慣れてくると見えるようになるのはなぜか?」普段私たちが映画館や劇場に入った時に誰しも一度は考えたことのある疑問です。これは私たちの眼の網膜に存在する視細胞の一つ、桿体細胞の中で光を受容するタンパク質、ロドプシンが働いているからです。ロドプシンは7本のαへリックスが細胞膜を貫通した共通構造を有するGタンパク質共役型受容体 (※1) の一員であり、タンパク質内部に光を吸収する発色団分子、11シス型のレチナール (ビタミンA誘導体) を結合させることで光吸収を実現しています。ロドプシンが光を吸収すると、レチナールが11シス型から全トランス型への異性化反応を起こし、この小さな化学反応をレチナールを取り囲む周辺のタンパク質環境が受け取ることで活性化状態となります。光シグナルは、この活性化されたロドプシンにより細胞内でのGタンパク質を介して下流のエフェクター分子へと伝達されていく過程で電気シグナルへと変換され、視神経を伝って脳に伝わることで、私たちは初めて「もの」を認識できるのです (図1)。
一方、ロドプシン自身はレチナールを11シス型へ戻す機能を有しておらず、タンパク質内部から全トランス型レチナールを解離させ、視細胞に隣接する網膜色素上皮細胞に運んで多段階の酵素反応を経由 (レチノイド回路) することにより再生された11シスレチナールを再利用しています。もし、レチノイド回路が異常をきたしてシス型レチナールの供給が遅れると、ロドプシンが再生されなかったり、細胞内において毒性を発する全トランス型レチナールが蓄積して視細胞変性を引き起こし、最終的に網膜疾患や失明につながる恐れがあります。これらの疾患の治療薬開発に向けて、視覚研究に携わる研究者が (ウシ) ロドプシンの結晶構造 (※2) を基にした新規化合物の探索や細胞活性実験、マウスによる個体レベルの臨床研究に取り組んでいるのが現状です。
図1:明暗を認識する光受容タンパク質ロドプシンの光シグナル伝達
ユニークな発色団の光異性化反応を利用したロドプシンの光シグナル伝達機構の解明
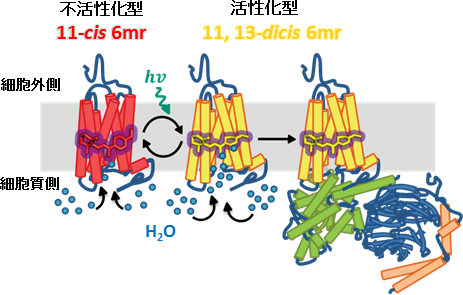
今回、片山助教らの研究チームは11シス型から全トランス型への異性化をブロックしたレチナールを発色団とする (ウシ) ロドプシンアナログの分子特性に着目しました。これまでに11シス型を5, 6, 7, 8員環で固定したレチナールアナログを発色団とするロドプシンアナログに対する分光測定やGタンパク質の活性測定に関する研究成果は多数報告されており、中でも6員環で固定されたレチナールアナログによって再生されたロドプシン (Rh6mr) は、11シスー全トランスの異性化がブロックされているにも関わらずGタンパク質を活性化できることが知られていました。片山助教らはRh6mrがどのようなメカニズムでGタンパク質を活性化しているのか、その分子機構を明らかにするために、時間分解蛍光分光測定によるGタンパク質の活性化測定、時間依存的可視吸収スペクトル測定、HPLCによるレチナールアナログ組成解析、高分解能X線回折測定による結晶構造解析、さらには分子力学計算を組み合わせた網羅的な構造―機能相関解析を行いました。
その結果、Rh6mrは光吸収に伴いレチナールアナログの13位の部位で異性化を起こし (11, 13ジシス型)、短波長シフトした活性中間体を生成することを明らかにしました。さらにこの活性中間体はレチナールを解離させることなく、数時間という非常に遅い時間スケールで熱的に11シス型に戻ること、さらには繰り返しGタンパク質を活性化できることを見出しました (図2)。このように今回、脊椎動物が有するロドプシンとしては初めて、光反応サイクルを示すロドプシンの存在を実験的に明らかにすることができました。興味深いことに、ロドプシンとRh6mrとのGタンパク質活性化能の比較を行ったところ、本来のレチナールの異性化とは異なる部位で異性化反応が起きているにも関わらず同程度の活性化能を示す一方、レチナールの異性化効率 (量子収率) はレチナールアナログの方が20倍以上低いことも実証しました。
さらに片山助教らは暗条件におけるRh6mrに対し、4.01 Åの分解能で構造決定に成功しました。元々レチナールアナログは有機溶媒中では4種類の異性化構造をとることが分かっていますが、得られたRh6mrの構造から、タンパク質内部に存在するレチナールアナログは11シス型で結合していることが分かりました。また、分子力学計算によるドッキングシミュレーションの結果からも、11シス型の構造がエネルギー的に最安定構造をとることが示唆されました。
(Rh6mr) の光反応サイクルおよび光シグナル伝達
網膜疾患の治療薬開発への期待
このように今回、片山助教らは、生物物理学的な多岐にわたる手法を駆使することで、人工的に合成したレチナールアナログによって再生されたロドプシン、Rh6mrの分子特性およびGタンパク質の活性化メカニズムを原子・分子レベルで明らかにしました。私たちの視覚機能の発現にはロドプシンとレチノイド回路の存在は必要不可欠であり、もしこれらに異常が起きれば、失明する恐れさえあります。しかし今回、明らかにしたRh6mr特有の光反応サイクルおよび繰り返しGタンパク質を活性化できる特性を生かすことで、例えばレチナールアナログ混在の点眼薬を投与することで自発的に私たちの網膜中でRh6mrが再生され、毒性を帯びる全トランスレチナールを産生することなく、Gタンパク質を活性化し光情報を視覚情報へと変換することが期待されます。また今回、構造決定に成功したRh6mrの構造をもとに高い光異性化効率と早い光反応サイクルを実現できる新規レチナールアナログの設計を行うことで、網膜疾患の治療薬開発への貢献が期待されます。
※今回の研究はアメリカ国立衛生研究所 (NIH)、全米科学財団 (NSF)、日本学術振興会(JSPS)の科研費補助金の支援により実施されました。
用語解説
※1 Gタンパク質共役型受容体
真核細胞の細胞膜上あるいは、細胞内部の構成膜上に発現する受容体の一種。7本のαヘリックスが細胞膜を貫通した共通構造を有しており、細胞外からの様々なシグナル (光、神経伝達物質、ホルモン、化学物質等) を受容し、Gタンパク質を介して細胞内側へとシグナルを伝達させる。
※2 結晶構造
結晶中の原子の配置構造を指す。私たち生物を形作る生体高分子、タンパク質や核酸のアミノ酸配列 (一次構造) だけでは、それぞれのタンパク質独自の生理的機能を理解することができず、原子レベルでの三次元構造を可視化することが必要不可欠である。結晶構造とは、目的タンパク質の結晶を作製し、X線のような強いビームを当てることで生じる回折パターンから原子配置を決定し、得られた三次元構造に対応する。
本件への問い合わせ
名古屋工業大学大学院工学研究科 生命・応用化学専攻 生命・物質化学分野
片山 耕大(かたやま こうた)
電子メール:katayama.kota[at]nitech.ac.jp
名古屋工業大学企画広報課 広報室
電話:052-735-5647 電子メール:pr[at]adm.nitech.ac.jp
小児医療現場におけるバーチャルリアリティ(VR)技術を活用した実証実験を開始 国際未来情報学シンポジウム開催のご案内