光でイオンを輸送するタンパク質、ロドプシンの吸収波長の長波長化に成功 -脳深部の神経ネットワークを解明する技術へ-
News&Topics
カテゴリ:プレスリリース|2019年5月10日掲載
東京大学物性研究所
名古屋工業大学
科学技術振興機構
1. 発表者
井上 圭一(東京大学物性研究所 准教授)
神取 秀樹(名古屋工業大学大学院工学研究科 生命・応用化学専攻 教授)
2.発表のポイント
◆脳科学研究分野で用いられる、光でイオンを輸送するタンパク質(ロドプシン)のアミノ酸を改変し、これまでにない吸収波長の長波長化を達成した。
◆今後本技術を用いたさらなる分子ツールの開発や、精神疾患などに関わる脳神経ネットワークの解明が期待される。
3. 発表概要
東京大学物性研究所の井上圭一准教授と名古屋工業大学大学院工学研究科 生命・応用化学専攻の神取秀樹教授らはイタリアのシエナ大学などとの国際共同研究により、ロドプシンのアミノ酸を改変することで、従来より長波長の光で操作が可能な新しい人工ロドプシンタンパク質を作製することに成功した。
ロドプシンは光のエネルギーを使ってはたらくタンパク質の一種であり、動物や微生物の生体内で視覚情報の伝達や、光によるイオンの輸送などを行っている。近年では、光で脳神経回路を調べる光遺伝学(オプトジェネティクス)技術への応用、さらに視覚再生などの医療応用についても強い注目を集めている。
しかし、ヒトを含む動物の生体組織は可視光を強く散乱するため、深部組織へ光を導入することが困難であった。これに対し本研究グループは、生体組織による散乱の少ない長波長の光を吸収し反応するロドプシンをアミノ酸変異により作製した。これにより、深部脳組織に導入したロドプシンを光操作することが可能になり、これまで調べることが困難であった脳神経ネットワークのオプトジェネティクス研究が可能となる。また今後、うつ病などの精神疾患の治療法解明へとつながることが期待される。
本研究成果は英国のオンライン科学雑誌「Nature Communications」誌(2019年4月30日付)に掲載された。
4.発表内容
①研究の背景
■ 光のエネルギーを使ってイオンを運ぶタンパク質、ロドプシン
我々ヒトを含む動物は目の中の網膜にある細胞を使って光をとらえ、物体の形や色を認識することができる。その際に、光を吸収し脳に視覚情報を伝える役割を持つのがロドプシンと呼ばれるタンパク質である。
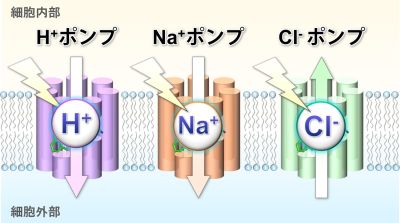
一方で生物の細胞の中は水素イオン(H+)やナトリウムイオン(Na+)、塩化物イオン(Cl-)など、様々なイオンが存在している。そして細胞の内外でこれらのイオンの間に濃度差が生じると、細胞内に電気的なエネルギーが生み出され、細胞の生存に必要な様々な活動に用いられる。そして海洋や湖沼、河川などに棲む細菌は、細胞を包む細胞膜の中に光のエネルギーを使って様々なイオンを輸送する微生物型のロドプシン(注1)を持っている。これまでの研究により海水中に多量に存在するH+やCl-をポンプ(注2)のように輸送するロドプシンが見つかっており、さらに2013年には神取教授と井上准教授らにより、新たにNa+をポンプするロドプシンが自然界に存在することが報告されている(図1)。これらのロドプシンがイオンを輸送すると、例えばH+ポンプとして機能するロドプシンの場合、光のエネルギーを用いてH+を細胞外部へ輸送することにより、細胞の内外でH+の濃度差が作られる。そしてこのイオンの濃度差を駆動力として、細胞内により大きな電気化学エネルギーが生み出され、アデノシン三リン酸(ATP)など細胞の活動に必要な物質の合成が行われる。
■ ロドプシンとオプトジェネティクス
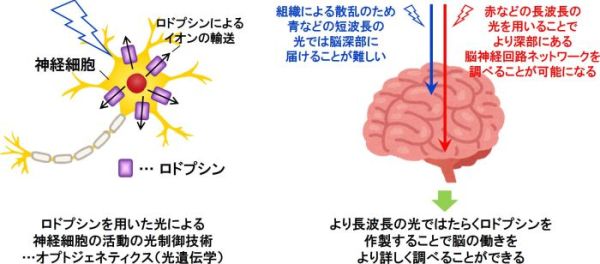
近年、遺伝子操作技術を用いて、マウスやゼブラフィッシュなどの動物の脳神経ネットワークを構成する特定の神経細胞に微生物型のロドプシンを導入し、ロドプシンが行うイオン輸送を通じて、神経細胞の興奮や抑制を光で自在に操作するオプトジェネティクス(光遺伝学)技術(注3)が注目を集めている(図2左)。この技術を用いることで、脳神経ネットワーク内の神経細胞のつながりや、様々な種類の神経細胞が関わる行動や感情、思考、精神疾患などについて調べることが可能になってきている。しかし、脳などの生体組織は光を強く散乱する性質を持つことから、青や緑色などの従来のロドプシンの動作に必要とされていた比較的短波長の光では、脳深部の光操作が困難であった。そこでより長波長の光である黄色や赤色の光で操作可能なロドプシンの開発が望まれていた(図2右)。
②研究の内容と成果
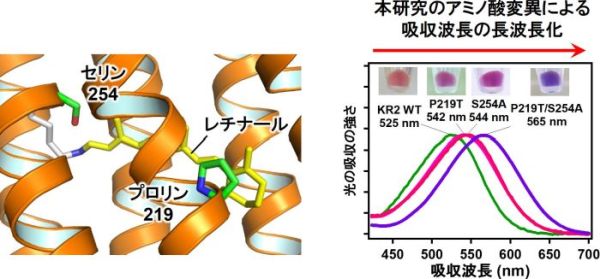
また、井上准教授と神取教授らは赤外分光法や計算機シミュレーションにより、作製した長波長吸収型のNa+ポンプ型ロドプシンの分子構造と長波長吸収化のメカニズムも明らかにした。さらに、今回発見された変異によるレチナールの吸収波長の変化は、自然界に存在する特定の細菌の中でも生じていることも明らかにし、自然界で起こるタンパク質の進化についても新たな知見が得られた。
③今後の展望
5.発表雑誌
雑誌名:「Nature Communications」(10巻、1993(2019))
論文タイトル:Red-shifting Mutation of Light-driven Sodium Pump Rhodopsin
著者:Keiichi Inoue, Maria del Carmen Marin, Sahoko Tomida, Ryoko Nakamura,
Yuta Nakajima, Massimo Olivucci, Hideki Kandori*
DOI番号:10.1038/s41467-019-10000-x
アブストラクトURL:https://www.nature.com/articles/s41467-019-10000-x
6.問い合わせ先
【研究に関すること】
【報道に関すること】
名古屋工業大学 企画広報課
E-mail: pr[at]adm.nitech.ac.jp
科学技術振興機構 広報課
E-mail: jstkoho[at]jst.go.jp
【JST事業に関すること】
7.用語解説
(注1) 微生物型ロドプシン
細菌などの主に単細胞の微生物が持つ、光のエネルギーを使って機能するタンパク質。細菌の細胞内では、細胞の外側を取り囲む細胞膜中に存在し、H+やCl-、Na+などのイオンを細胞の内外に輸送する機能を持ち、近年では動物の神経細胞を光で操作するオプトジェネティクス(光遺伝学)で広く用いられている。
genetics(遺伝学)にopto(光)の接頭辞を付けた言葉であり、2006年にスタンフォード大学のKarl Deisseroth博士によって初めて用いられた。元々は「遺伝学的手法を用いて目的の神経細胞に光駆動性イオン輸送体を発現させ、光でこれを活性化させることにより神経細胞を興奮、抑制させるという実験技術、及びその実験分野」のことを指して用いた。現在は、神経細胞以外の細胞、光駆動性イオン輸送体以外の光応答性タンパク質を用いた場合にもこの言葉が適用されている。(本プレスリリースでは原義に近い意味で用いられている)
光吸収性タンパク質の内部には、光を吸収するための色素分子が結合する。この光吸収性の色素分子のことを発色団と呼び、ロドプシンの場合は、ビタミンAの誘導体であるレチナールがそれにあたる。レチナールの吸収波長は周りにあるアミノ酸の種類によって変化し、今回の研究では新しいタイプのアミノ酸変異によって、従来よりもロドプシンの吸収波長を40 nm長波長化することに成功した。
タンパク質を構成する生体分子。20種類のアミノ酸残基が直鎖状につながることで、タンパク質分子が構築される。
8.添付資料
2019年度女性技術者リーダー養成塾第5期の受講募集を開始しました 柴田哲男教授がアメリカ化学会National Awardsを受賞 フッ素化学研究の貢献が高く評価される

