催奇性を回避できるサリドマイドの改良とPROTACへの応用 - 重篤な副作用を軽減したタンパク質分解誘導剤開発への第一歩-
News&Topics
カテゴリ:プレスリリース|2023年8月21日掲載
愛媛大学
名古屋工業大学
京都大学
このたび、愛媛大学プロテオサイエンスセンターの山中聡士特定助教、澤崎達也教授、降旗大岳特定研究員、柳原裕太特定助教、今井祐記教授、名古屋工業大学大学院工学研究科の柴田哲男教授、徳島大学先端酵素学研究所の小迫英尊教授、京都大学大学院生命科学研究科の宮川拓也准教授、東京大学の田之倉優名誉教授らの研究グループは、サリドマイドの重篤な副作用である催奇形性を軽減したサリドマイドの改良とそれを応用した新たなPROTACの開発に成功しました。
サリドマイドは半世紀以上前に開発され、胎児に重篤な催奇性を誘発し、世界最大の薬害を引き起こした低分子薬剤として広く知られています。現在、サリドマイド誘導体は血液がんの治療薬として年間約1兆円以上の規模で使用されています。しかしながら、催奇性を回避したサリドマイド誘導体は報告されていません。これまでの研究から、サリドマイドやサリドマイド誘導体はタンパク質を分解誘導するタンパク質分解誘導剤であることが明らかになっていました。本研究では、抗血液がん作用に関与するタンパク質を選択的に分解誘導するサリドマイド誘導体の開発を行いました。開発したサリドマイド誘導体は、多発性骨髄腫や5q MDS症候群などに既存薬レナリドミドと同等以上の抗増殖活性を示しました。さらに、次世代の治療薬として期待されているキメラ化合物PROTACへ応用したところ、催奇性に関与するタンパク質の分解が抑制され、薬効標的タンパク質をより選択的に分解誘導することを示しました。本研究成果により、催奇性を回避したサリドマイド誘導体の開発や様々な疾患に対する選択的なPROTACsの開発が促進されることが期待されます。
この研究成果に関する論文は、2023年8月18日付けでNature Communications誌に掲載されました。
1.背景
サリドマイド1)は1950年代に開発され、妊婦における睡眠導入剤として世界中で使用された薬剤ですが、妊婦が服用すると胎児に重篤な催奇性2)を引き起こしたことから、サリドマイド薬禍といわれる世界規模の薬害問題を引き起こしました。現在、多発性骨髄腫などの血液がんに対する薬効が非常に高いことから、サリドマイド誘導体 3) (レナリドミド及びポマリドミド) は厳格な安全管理のもと、治療薬として年間約1兆円以上の規模で使用されている代表的な低分子薬剤です。サリドマイドやサリドマイド誘導体 (Immunomodulatory drugs)は、特定の「タンパク質分解をする」複合体(CRL4複合体)の基質認識を担うセレブロン(CRBN4)、E3ユビキチンリガーゼ)へ結合することにより、本来の基質ではない「ネオ基質」を分解し、その結果、多様な薬理作用および副作用を示すことが明らかとなっています(図1)。
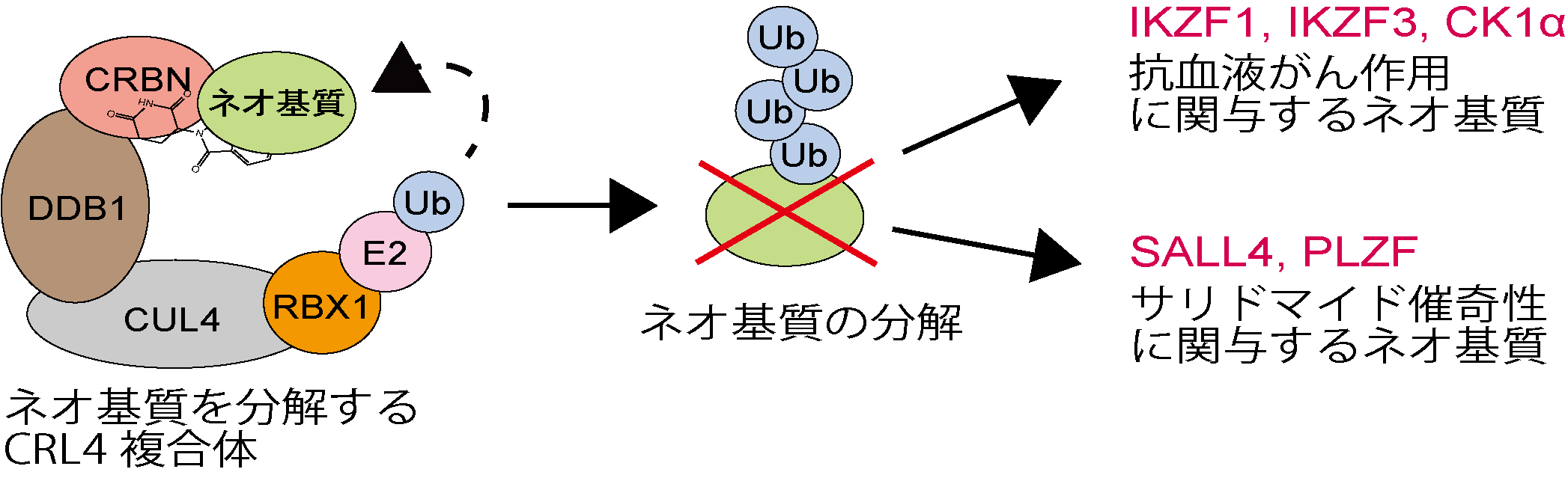
図1. サリドマイドやサリドマイド誘導体依存的なネオ基質の分解および薬理作用・副作用に関与するネオ基質の模式図
サリドマイドやサリドマイド誘導体は、セレブロンと標的タンパク質の間をまるで"分子糊"のように密接させることにより分解誘導することから、Molecular glue(分子糊)型のタンパク質分解誘導剤5)と呼ばれています。このように、サリドマイドやその誘導体はタンパク質分解というまったく新しく、そして強力な薬剤の作用機序を切り拓きました。さらに現在では、サリドマイドやその誘導体を応用し、サリドマイドやその誘導体(E3バインダー)と標的タンパク質に結合する化合物(標的バインダー)を繋ぎ合わせたキメラ化合物であるPROTAC (Proteolysis targeting chimera:タンパク質分解誘導キメラ分子)6)型のタンパク質分解誘導剤が開発されています。タンパク質分解誘導剤は、これまでに治療薬の標的にすることが困難であった、酵素の様な特徴的なポケットをもたないタンパク質を標的にできることから、次世代の創薬アプローチとして世界中で大きく期待されています。
しかしながら、サリドマイドやその誘導体やそれらを用いたPROTACは、残念なことに、サリドマイドの重篤な副作用である催奇性を引き越すネオ基質を分解することが知られており、PROTACを若い世代に利用するためには、この問題を解決する必要がありました。
本研究グループはこれまでに、サリドマイド催奇性に関与するネオ基質としてPLZFを発見し(参考文献1)、サリドマイドの光学異性体における基質選択性機構を構造学的知見から明らかにし(参考文献2)、サリドマイド催奇性の分子メカニズムを提唱しています (参考文献1)。さらに、サリドマイドやその誘導体依存的なCRBN-ネオ基質間相互作用を高感度・簡便に解析する技術を開発し、サリドマイドやその誘導体のネオ基質選択性を評価することが可能であることを報告しています(参考文献1-4)。これらの研究的な背景から、我々が開発してきた技術を用いることにより、抗血液がん作用に関与するネオ基質を分解誘導し、サリドマイド催奇性に関与するネオ基質を分解誘導しない、新しく改良したサリドマイド誘導体が開発可能であると考えました。
2.研究成果
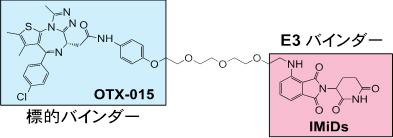
はじめに、サリドマイドやサリドマイド誘導体のネオ基質選択性に重要であるフタルミド環(図2)を様々な置換基にて修飾したサリドマイド誘導体を有機合成しました。有機合成したサリドマイド誘導体のネオ基質選択性を詳細に解析した結果、レナリドミドの6位をフッ素や塩素などの比較的小さな原子で置換したレナリドミド誘導体(図3)は、抗血液がん作用に関与するネオ基質(IKZF1やIKZF3、CK1α)を分解誘導する一方で、催奇性に関与するネオ基質(SALL4やPLZF)の分解誘導は弱いことを明らかとなりました(図3)。さらに、6位フッ素化レナリドミド(F-Le)は、サリドマイドやその誘導体が治療薬として用いられている血液がんである多発性骨髄腫や5番染色体欠損骨髄異形成症候群由来の培養細胞に対して、既存薬レナリドミドと同等以上の抗増殖作用を示しました(図3)。CRBNは様々な組織・細胞に発現しタンパク質の分解活性が高く、サリドマイドやその誘導体は分子量が小さいE3バインダーであるため、様々な疾患に対するPROTACへと利用されています。しかしながら、血液がん以外の疾患を対象にする場合、血液細胞の分化制御するネオ基質(IKZF1やIKZF3、CK1α)の分解は副作用を惹起する可能性があります(図4)。そこで、私たちはレナリドミドの6位をより嵩高い置換基で置換したサリドマイド誘導体を有機合成しました。その結果、レナリドミドの6位をトリフルオロメチル基(F3C-基)のような大きな置換基で修飾したレナリドミドは、催奇性に関与するネオ基質(SALL4やPLZF)だけでなく、抗血液がん作用関与ネオ基質(IKZF1やIKZF3、CK1α)の分解も引き起こさないことを明らかにしました。次に、本研究で見出した6位修飾レナリドミドと様々ながん種において治療標的とされているBETタンパク質(BRD2、BRD3、BRD4)に対する阻害剤OTX-015を用いたPROTACsを有機合成しました(図4)。重要なことに、6位修飾レナリドミドを用いたPROTACsはBETタンパク質を分解誘導し、6位修飾レナリドミドと同様のネオ基質選択性を示しました。さらに、6位修飾レナリドミドを用いたPROTACは神経芽細胞腫や大腸がん由来の培養細胞株に対して顕著な抗増殖作用を示しました。つまり、PROTACとして機能できるが、既知のネオ基質を分解しない改良サリドマイド誘導体の開発に成功したのです。これらの結果は、6位修飾レナリドミドが催奇性を回避した血液がんに有効なサリドマイド誘導体であり、さらにこれらの化合物が疾患標的タンパク質を選択的に分解できるPROTAC開発に利用できることを示しています。
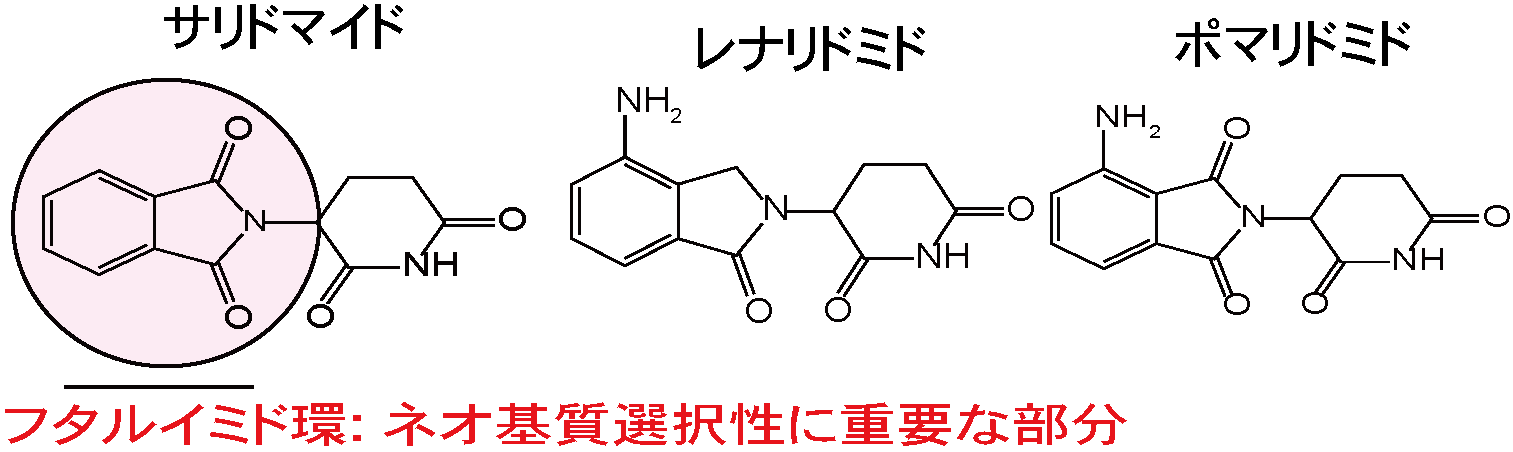
図2. サリドマイドとその誘導体の化学構造とネオ基質選択性において重要な化学構造
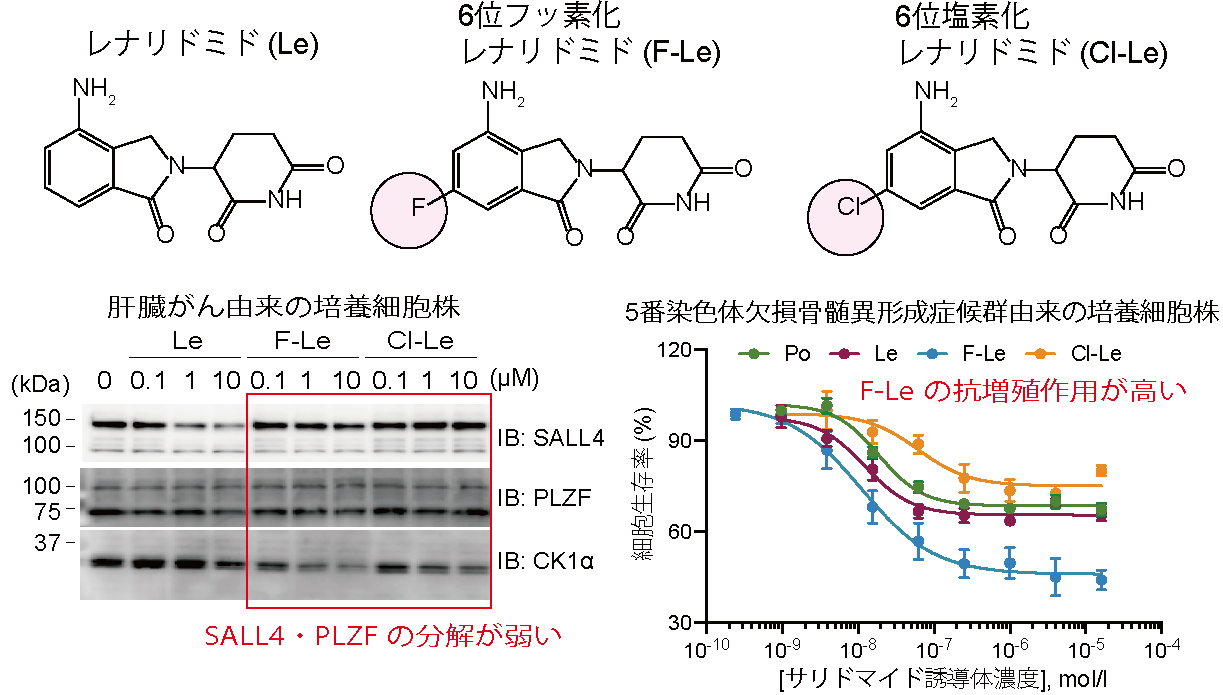
図3. レナリドミドとその誘導体の化学構造(上)とネオ基質分解活性の評価及びがん細胞に対する抗増殖作用の評価(下)
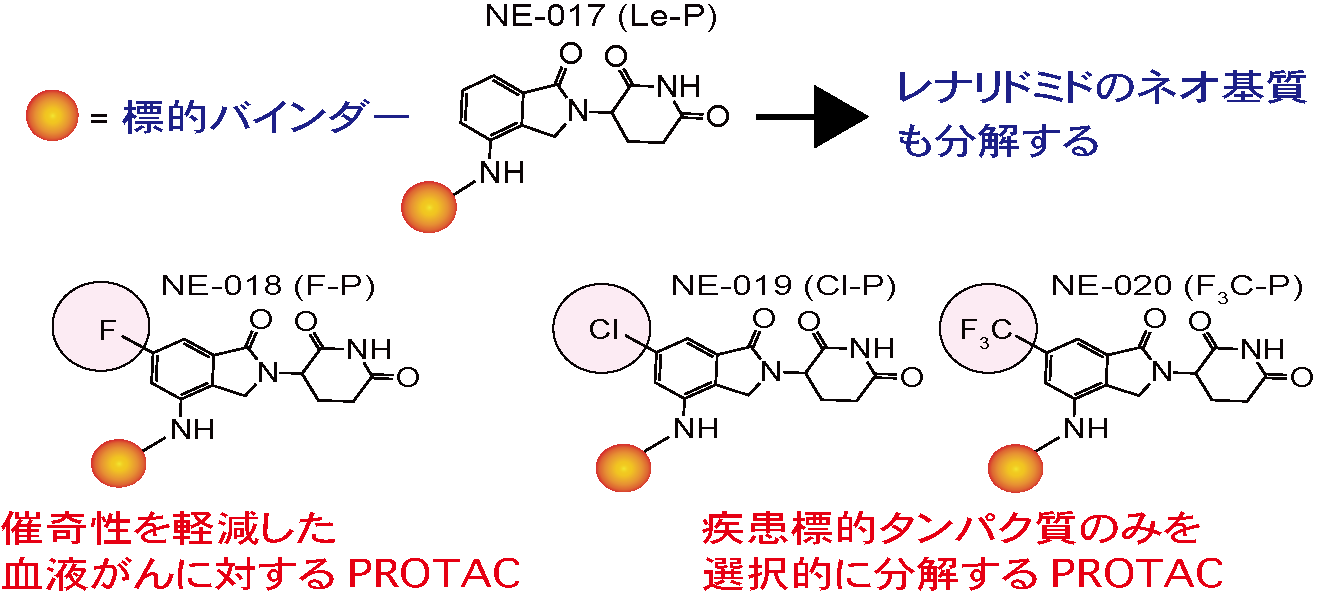
図4. レナリドミドとその誘導体を用いたPROTACの化学構造とネオ選択性の概要
3.波及効果
タンパク質分解誘導剤は、細胞内からネオ基質や標的タンパク質を徹底的に取り除きます。その効果は絶大で、多発性骨髄腫への高い治療効果を示す一方で、胎児の催奇性を引き越すほど重篤な副作用も引き起こしました。したがって、標的となるタンパク質のみを正確に分解するタンパク質分解誘導剤の開発は極めて重要であります。本研究において開発されたレナリドミド誘導体は、抗血液がん作用に関与するネオ基質を特異的に分解し、既存薬として最も広く用いられているレナリドミドと比較して、同等以上の抗増殖作用を示しました。今後、生体内における抗腫瘍効果及び催奇性誘発能の評価を行い、サリドマイド催奇性を回避した血液がんに有効なサリドマイド誘導体が開発されることが期待されます。また現在、より強力な抗血液がん作用をもつ新規なサリドマイド誘導体の開発が行われており、既に臨床段階にあります。したがって、本研究において得られた知見を活用することで、より有効性の高い安全な新規サリドマイド誘導体の開発につながることが期待されます。さらに様々な研究から、サリドマイドやその誘導体を用いたPROTACは非常に有効性が高いことが証明されており、既にいくつかのPROTACは臨床段階にあります。したがって、本研究で見出したネオ基質選択性を制御可能なレナリドミド誘導体を用いることで、副作用を軽減したPROTACの開発につながることが大きく期待されます。
4.研究体制と支援について
本研究は、愛媛大学 プロテオサイエンスセンター、名古屋工業大学大学院工学研究科、徳島大学 先端酵素学研究所 藤井節郎記念医科学センター、京都大学大学院生命科学研究科との共同研究としておこなわれました。
また、研究の実施にあたっては、日本医療研究開発機構(AMED)次世代がん医療創生研究事業/次世代がん医療加速化研究事業(P-CREATE/ P-PROMOTE)「催奇性を回避した血液がん治療に有効な新規サリドマイド誘導体の開発」、武田科学振興財団、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)「コムギ無細胞系とAirIDを基盤とした複合体生産・探索・解析技術の支援と高度化」、科学研究費助成事業、徳島大学先端酵素学研究所共同利用・共同研究拠点事業、愛媛大学プロテオインタラクトーム解析共同利用・共同研究拠点事業(PRiME)の支援を受けました。
論文タイトルと著者
タイトル:Lenalidomide derivatives and proteolysis-targeting chimaeras for controlling neosubstrate degradation
(和訳) ネオ基質分解を制御したレナリドミド誘導体及びPROTACsの開発
著者:山中 聡士(愛媛大学), 降旗 大岳(愛媛大学), 柳原 裕太(愛媛大学), 田谷 彬人(研究当時:名古屋工業大学), 長坂 天斗(研究当時:名古屋工業大学), 臼井 麻衣(名古屋工業大学), 長岡 昂冶(愛媛大学), 庄屋 祐希(研究当時:愛媛大学), 西野 耕平(徳島大学), 吉田 周平(愛媛大学), 小迫 英尊(徳島大学), 田之倉 優(東京大学), 宮川 拓也(京都大学), 今井 祐記(愛媛大学), 柴田 哲男(名古屋工業大学), 澤崎 達也(愛媛大学)
掲載誌 : Nature Communications
Journal link: https://www.nature.com/ncomms/
D O I : 10.1038/s41467-023-40385-9
掲載日:2023年8月18日(金)
用語説明
1) サリドマイド
睡眠作用および免疫調整作用を持つ低分子薬剤であり、多発性骨髄腫などの血液がんやハンセン病による2型らい反応に対する治療薬として利用されている。
2) 催奇性
薬剤などのある種の物質が生物の正常な発生を阻害して奇形を生じさせる性質や作用のことで、催奇形性と同義で使われる。
3) レナリドミドおよびポマリドミド
サリドマイド誘導体であり、免疫調整薬IMiDsとして多発性骨髄腫などの血液がんに使用されている低分子薬剤である。イカロスやアイオロスと呼ばれるタンパク質を強力に分解誘導する。
4) セレブロン
タンパク質のユビキチン化を引き起こす酵素群であるE3ユビキチンリガーゼの1種。細胞内で基質タンパク質をユビキチン化し、ユビキチン化されたタンパク質はプロテアソームによって分解される。
5) タンパク質分解誘導剤
細胞内のタンパク質分解システムをハイジャックし、標的タンパク質を分解誘導する化合物。疾患に関与するタンパク質を分解誘導するという新たな作用機序を切り開いた化合物であり、近年の創薬研究において注目されている。
6) PROTAC (Proteolysis targeting chimera)
E3ユビキチンリガーゼに相互作用する低分子化合物(E3バインダー)と標的タンパク質に相互作用する(標的バインダー)をリンカーで繋ぎ合わせたキメラ化合物である。疾患に関与する標的タンパク質を分解誘導するという新たな作用機序を有する化合物であり、標的タンパク質を触媒反応によって徹底的に細胞内から除去するため、効果が強力である。また、これまで薬剤の標的にすることが困難であった酵素活性を持たないようなタンパク質も標的となり得る。
参考文献1
Yamanaka, S., Murai, H., Saito, D., Abe, G., Tokunaga, E., Iwasaki, T., Takahashi, H., Takeda, H., Suzuki, T., Shibata, N., Tamura, K., & Sawasaki, T. (2021) Thalidomide and its metabolite 5-hydroxythalidomide induce teratogenicity via the cereblon neosubstrate PLZF EMBO J., 40, e105375. doi: 10.15252/embj.2020105375.
参考文献2
Furihata, H., Yamanaka, S., Honda, T., Miyauchi, Y., Asano, A., Shibata, N., Tanokura, M., Sawasaki, T., & Miyakawa, T. (2020) Structural bases of IMiD selectivity that emerges by 5-hydroxythalidomide. Nat. Commun., 11: 4578. doi: 10.1038/s41467-020-18488-4.
参考文献3
Kido, K., Yamanaka, S., Nakano, S., Motani, K., Shinohara, S., Nozawa, A., Kosako, H., Ito, S., & Sawasaki, T. (2020) AirID, a novel proximity biotinylation enzyme, for analysis of protein-protein interactions. eLife, 9, e54983. doi: 10.7554/eLife.54983.
参考文献4
Yamanaka, S., Horiuchi, Y., Matsuoka, S., Kido, K., Nishino, K., Maeno, M., Shibata, N., Kosako, H., & Sawasaki, T. (2022) A proximity biotinylation-based approach to identify protein-E3 ligase interactions induced by PROTACs and molecular glues. Nat. Commun., 13, 183. doi: 10.1038/s41467-021-27818-z.
お問い合わせ先
研究に関すること
愛媛大学プロテオサイエンスセンター
特定助教 山中 聡士
TEL: 089-927-9931
Mail: yamanaka.satoshi.ze[at]ehime-u.ac.jp
愛媛大学プロテオサイエンスセンター
教授 澤崎 達也
TEL: 089-927-8530
Mail: sawasaki[at]ehime-u.ac.jp
名古屋工業大学大学院工学研究科 共同ナノメディシン科学専攻
教授 柴田 哲男
TEL: 052-735-7543
Mail: nozshiba[at]nitech.ac.jp
広報に関すること
愛媛大学 広報課広報チーム
TEL:089-927-9022 FAX:089-927-9052
E-mail:koho[at]stu.ehime-u.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
E-mail:pr[at]adm.nitech.ac.jp
京都大学 渉外部広報課国際広報室
TEL:075-753-5729 FAX:075-753-2094
E-mail:comms[at]mail2.adm.kyoto-u.ac.jp
*[at]を@に置換してください。
微生物が光に反応してカリウムイオンを運ぶしくみの解明と神経科学への応用 ――四半世紀ぶりに発見された全く新規のカリウムイオン選択性のしくみ―― 無線電力伝送の世界初月面実証を目指した産学官連携共同研究を開始 -月面のあらゆる場所に無線でエネルギーを供給し探査を加速-

