アスガルドアーキアの持つ、光エネルギーを使って水素イオンを取込むタンパク質の構造を解明
News&Topics
カテゴリ:プレスリリース|2021年4月 1日掲載
東京大学
名古屋工業大学
1. 発表者
樋口 昌光(研究当時 東京大学大学院理学系研究科生物科学専攻 修士課程2年)
志甫谷 渉(東京大学大学院理学系研究科生物科学専攻 助教)
今野 雅恵(東京大学物性研究所 特任研究員)
神取 秀樹(名古屋工業大学大学院工学研究科 教授)
井上 圭一(東京大学物性研究所 准教授)
濡木 理(東京大学大学院理学系研究科生物科学専攻 教授)
2. 発表のポイント
◆アスガルドアーキアが持つロドプシンタンパク質(注1)の一種で、光のエネルギーを使って水素イオンを細胞内に取り込む機能をもつシゾロドプシンの立体構造を明らかにしました。
◆シゾロドプシンはタンパク質の細胞内側に面する部分が短い構造をしており、効率的に水素イオンを細胞内へ運ぶ仕組みを解明しました。
◆本研究は、シゾロドプシンが細胞内に水素イオンを効率的に運ぶために進化したことを示すとともに、構造情報を元に、シゾロドプシンを改変・高機能化し、脳神経疾患やアシドーシス(注2)などの疾患研究のための分子ツールとしての応用の道を拓くものです。
3. 発表概要
私たちヒトを含む、細胞に核を持つ生き物は真核生物と呼ばれ、全ての真核生物は核を持たないアーキアとよばれる生物から15~20億年前に進化したと考えられています。現存の生物種の中で、真核生物の起源となったアーキアに最も近いとされるのがアスガルドアーキアです。このアスガルドアーキアからは、2020年に光に応答するロドプシンの一種であるシゾロドプシンが発見され、水素イオンを細胞内へ運ぶ機能を持っていることが初めて報告されました。アスガルドアーキアが真核生物へと変化する過程で、太陽光や酸素のある環境に順応するために、シゾロドプシンによる水素イオンの取込みが関わっている可能性があります。しかし、シゾロドプシンが水素イオンを、どの様にして効率的に細胞内に運ぶのか、そのメカニズムは不明でした。
今回、東京大学大学院理学系研究科の濡木教授らのグループは、同物性研究所の井上准教授との共同研究のもと、X線結晶構造解析(注3)によりシゾロドプシンの立体構造を決定しました。シゾロドプシンの構造を他のロドプシンと比較することで、従来不明だったロドプシンの分子進化におけるシゾロドプシンの位置づけを明らかにしました。また、シゾロドプシンは細胞内側の膜貫通領域が短く、水素イオンをタンパク質の細胞内側に放出しやすい構造をしており、細胞の外から取り込んだ水素イオンを細胞内側の溶媒へ直接放出するという、既知のロドプシンとは異なる水素イオンの輸送機構が明らかになりました。この研究によって、構造情報をもとにしたシゾロドプシンの機能改変ができるようになり、医学研究への分子ツールとしての応用研究が進展していくことが期待されます。
本研究成果は、日本時間2021年3月31日に米国科学アカデミー紀要(PNAS)に掲載されました。
4. 発表内容
研究の背景
私たちヒトを含む動物や植物などは、細胞の中に遺伝情報をコードしたDNAを包む核を持ち、真核生物と呼ばれています。一方で、大腸菌など原始的な生物は細胞内に核を持たず、原核生物と呼ばれています。その中で、近年アスガルドアーキアと呼ばれるグループの原核生物が、ゲノム配列の比較から真核生物に最も近い種であることが明らかになってきました。2020年には、海洋研究開発機構(JAMSTEC)を中心とした研究グループによって、アスガルドアーキアの培養の研究が報告されており(Imachi et al, 2020)(図1左)、原核生物と真核生物の境界の研究が盛んになっています。
このアスガルドアーキアのゲノム情報には、光のエネルギーを使ってさまざまな生理機能を発揮するロドプシンの中で、これまでにないタイプのものがありました。これはシゾロドプシンと呼ばれ、光エネルギーを使って細胞内へ水素イオンを取り込む機能を持つ分子です(図1右)(Inoue et al. 2020)。アスガルドアーキアが真核生物へと変化する過程で、太陽光や酸素のある環境に順応するために、シゾロドプシンによる水素イオンの取込みが関わっている可能性があります。南極で見つかった別の種類の生物が持つタンパク質も同様の配列と機能を持っており、シゾロドプシンは生物界に幅広く存在しています。
シゾロドプシンのアミノ酸配列は、長年知られているバクテリオロドプシン(注4)に代表されるタイプ1グループと、2018年に見つかった新種であるヘリオロドプシン(注5)の中間に位置しており、どちらに分類されるのかわかりませんでした(図1右)。また、微生物が持つ水素イオンを運ぶロドプシンの多数は、バクテリオロドプシンのような細胞外へ運ぶものが大部分であり、細胞内に運ぶものはごく少数です。その中でもシゾロドプシンは、他の内向き輸送型のロドプシンと比べ、非常に高効率な輸送を行うことが明らかとなっています。こうしたロドプシンとアミノ酸配列が大きく異なるシゾロドプシンの構造や、水素イオンを細胞内に運ぶ仕組みはわかっていませんでした。
研究内容と成果
本研究グループは、X線結晶構造解析を用いてシゾロドプシンの立体構造を明らかにしました(図2)。シゾロドプシンは3量体を形成しており、今までのロドプシンと同様に7本の膜貫通ヘリックス(TM)とアミノ酸の一つであるリジンに共有したレチナール色素(注6)で構成されていました。シゾロドプシンがタイプ1ロドプシンとヘリオロドプシンどちらに近いのか調べるために、構造を比較したところ、シゾロドプシンの細胞内や細胞外のループ構造はバクテリオロドプシンに近く、ヘリオロドプシンとは大きく異なっていました。よって、シゾロドプシンはタンパク質を構成するアミノ酸の配列こそ両者の中間ですが、既存のタイプ1に分類できることがわかりました。
次に、水素イオンの輸送メカニズムについて解析しました。暗闇状態では、水素イオンはレチナールのシッフ塩基に存在しており、光刺激が入るとそこから離れて、シゾロドプシンの細胞内側に存在するグルタミン酸を通して細胞内に放出されます(図3左)。一般的な水素イオンポンプでは、水素イオンはグルタミン酸などのアミノ酸残基や水分子の間を、玉突きのように転移していくことで輸送されます。しかしシゾロドプシンでは、このグルタミン酸は細胞内への水素イオンの輸送には必須であるにもかかわらず、水素イオンはこのアミノ酸にトラップされず、直接タンパク質から細胞の中へ放出されることが示唆されており、シゾロドプシンの水素イオン輸送メカニズムには大きな謎がありました。特徴的なことに、シゾロドプシンの細胞内側に面している部分は他のロドプシンと比べて短く、特にTM6は約13アミノ酸残基短いものでした(図2)。こうした構造的特徴によって、細胞内側のグルタミン酸が溶媒に露出しやすい構造を取っていることが明らかになりました(図3左)。水素イオンの通り道にあるアミノ酸改変体タンパク質(注7)を用いた実験によって、溶媒がタンパク質内部に流入しやすいことも示しました(図3右)。
こうした結果をもとに、光によって構造変化するとタンパク質内部に溶媒が入り込み、水素イオンがグルタミン酸に誘引されながら細胞の中へ直接放出されるという、シゾロドプシン独自の内向きプロトン輸送モデルを提唱しました(図4)。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木理)や基盤研究(B)「光駆動型内向きプロトンポンプの輸送メカニズム解明とオプトジェネティクスへの応用」(課題番号:17H03007 研究代表者:井上圭一)、若手研究「非古典的ロドプシンの構造機能解析」(課題番号:20K15728 研究代表者:志甫谷 渉)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。また、科学技術振興機構(JST)CREST「細胞内二次メッセンジャーの光操作開発と応用」(研究代表者:神取秀樹)の支援により行われました。
今後の展望
本研究は、細胞内に水素イオンを効率的に取り込むために、シゾロドプシンの形が進化してきたことを示しており、アスガルドアーキアでの生理的な重要性が示唆されます。今後は、本来のアスガルドアーキアの中で細胞の内向き水素イオン輸送がどのような役割を果たすのか、その解明に向けた研究が必要になると考えられます。 本研究で明らかになった、細胞の中へ直接水素イオンを放出するというメカニズムは、生体内での水素イオン輸送機構に一石を投じるものであり、他のタンパク質の分子メカニズムの理解へつながると期待されます。また、神経細胞へシゾロドプシンを発現することで、任意の神経細胞の興奮を光で操作することが可能になると考えられ、脳の神経細胞が関連するうつ病などの発病メカニズムの研究や、血液の酸性化に伴う、細胞疾患であるアシドーシスなどの機構解明に向けた分子ツールとして、構造情報をもとにしたシゾロドプシンの改変や医学研究への応用も期待されます。
5. 発表雑誌
雑誌名:Proceedings of the National Academy of Sciences of the United States of America
論文タイトル:Crystal structure of schizorhodopsin reveals mechanism of inward proton pumping
著者:Akimitsu Higuchi‡, Wataru Shihoya‡*, Masae Konno, Tatsuya Ikuta, Hideki Kandori, Keiichi Inoue*, Osamu Nureki*
‡共筆頭著者
*共同責任著者
DOI番号:10.1073/pnas.2016328118
論文URL:https://doi.org/10.1073/pnas.2016328118
6. 問い合わせ先
研究に関すること
東京大学大学院理学系研究科生物科学専攻
教授 濡木 理(ぬれき おさむ)
TEL:03-5841-4392
E-mail:nureki[at]bs.s.u-tokyo.ac.jp
東京大学物性研究所
准教授 井上 圭一(いのうえ けいいち)
TEL:04-7136-3230
E-mail:inoue[at]issp.u-tokyo.ac.jp
名古屋工業大学大学院工学研究科 生命・応用化学専攻
オプトバイオテクノロジー研究センター
教授 神取 秀樹(かんどり ひでき)
TEL:052-735-5207
E-mail:kandori[at]nitech.ac.jp
報道に関すること
東京大学大学院理学系研究科・理学部
学術支援職員 吉岡奈々子、教授・広報室長 飯野雄一
TEL:03-5841-0654
E-mail:kouhou.s[at]gs.mail.u-tokyo.ac.jp
東京大学物性研究所・広報室
TEL:04-7136-3207
E-mail:press[at]issp.u-tokyo.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
Email:pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
7. 用語解説
(注1)ロドプシンタンパク質
動物から細菌などの微生物まで、幅広い生物種の細胞膜上に存在する太陽光を吸収してさまざまな生物学的機能を発現するタンパク質。動物の持つロドプシンは視覚など光に関わるシグナル伝達を行う受容体であるのに対し、微生物の持つロドプシンの多くは光のエネルギーを使ってイオンを輸送する。従ってその機能は互いに大きく異なり、進化的にも全く別系統であるにも関わらず、光を吸収するために共にビタミン A の誘導体であるレチナール色素をタンパク質内部に結合し、7本の膜を貫通するらせん(ヘリックス)からなるタンパク質構造を持つなど多くの共通点がある。
(注2)アシドーシス
ヒトの血液は通常中性付近に保持されているが、何らかの原因で血液が酸性化する疾患。酸性化すると血中に大量の水素イオンが生じ、組織や細胞へ障害をもたらすことがある。
(注3)X線結晶構造解析
分子が規則正しく並んで形成された結晶にX線を照射すると得られる回折像を解析し、分子の3次元構造を解明する実験手法。クライオ電子顕微鏡、NMRなどと並んでタンパク質の立体構造を解析するのに用いられる。
(注4)バクテリオロドプシン
初めて発見された微生物型ロドプシンであり、光駆動型の水素イオン排出ポンプとして働く。細胞内外で水素イオンの濃度勾配を作ることで、これを別の蛋白質が利用してエネルギーを作る。
(注5)ヘリオロドプシン
補因子のレチナールと共有結合して光受容をする膜タンパク質。微生物型ロドプシンと動物型ロドプシンの大きく二つに分けられる。
(注6)レチナール色素
通常アミノ酸は可視領域に吸収を持たないため、アミノ酸で構成されるタンパク質もそれ単体では可視光を利用することができない。それに対してロドプシンはタンパク質内部に、体内の酵素反応でビタミンAから生じるレチナールと呼ばれる色素を結合している。ロドプシンのタンパク質内部にあるレチナールが可視光を吸収するとその構造が変化し、それを通じてタンパク質部分にも変化が起こり、さまざまな生理機能を発現することが可能になる。
(注7)アミノ酸改変体タンパク質
ロドプシンのタンパク質はおよそ200個程度のアミノ酸から構成されているが、遺伝子工学的な手法を用いることで、タンパク質上の任意の場所にあるアミノ酸を本来とは別の種類(アミノ酸は一般に20種類が生物の体内に存在する)のアミノ酸へと置き換えることができる。このように作製されるのがアミノ酸改変体タンパク質であり、その機能や物性を見ることで、本体のタンパク質において、それぞれのアミノ酸がどの様な役割を持つのかを調べることができる。
8. 添付資料
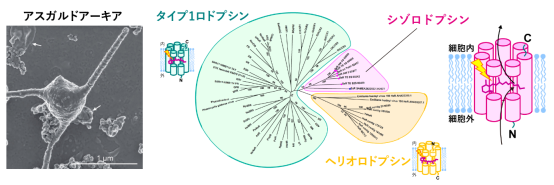
図1:シゾロドプシンの紹介
(左)培養単離された、シゾロドプシンを持つものに近縁のアスガルドアーキアの写真((英) H. Imachi, M. K. Nobu, and JAMSTEC、(日) 井町寛之、延優、海洋研究開発機構)。触手状の長い突起を有している。
(右)今までに発見されたロドプシンの系統樹と、シゾロドプシンの模式図。
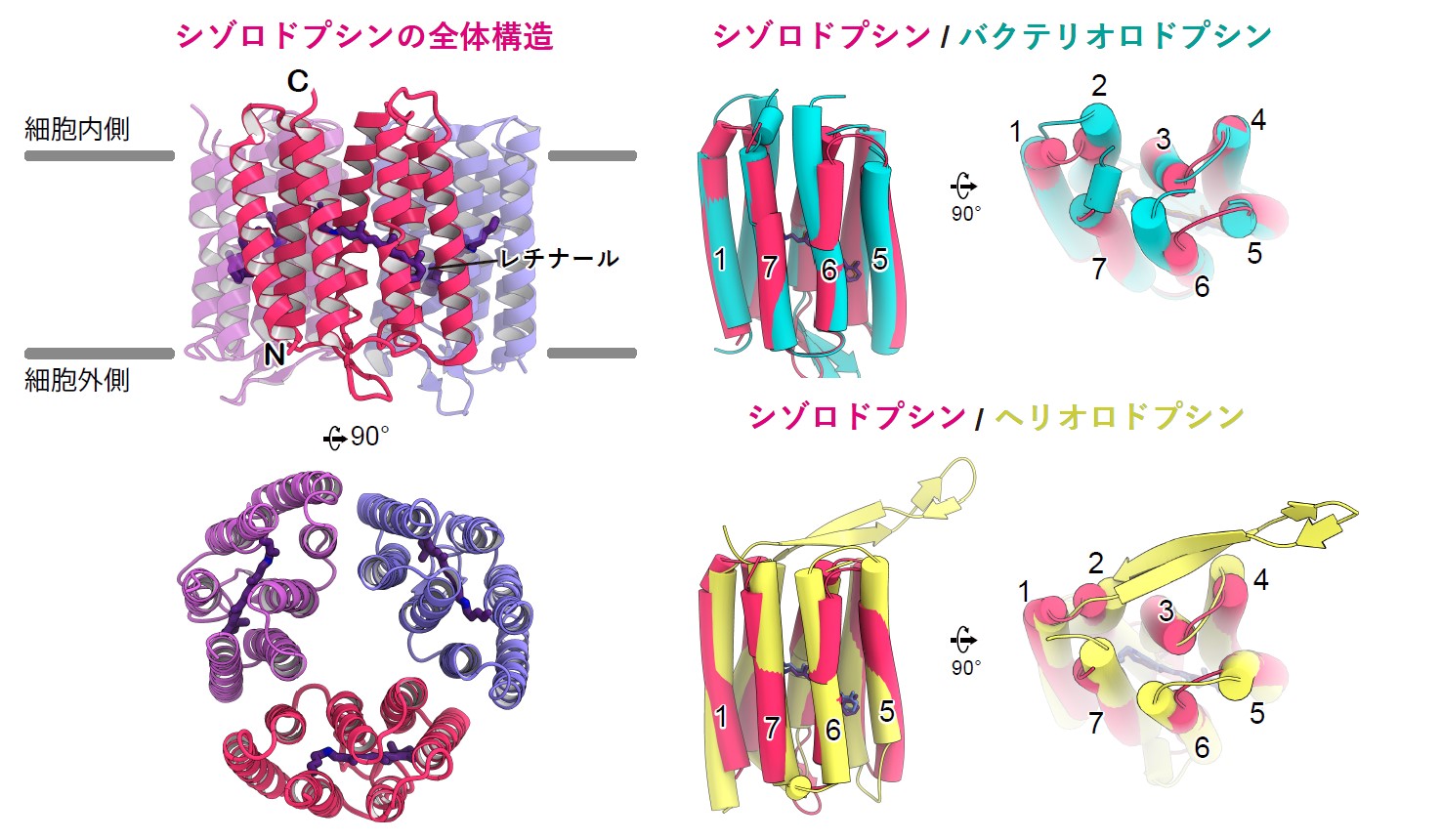
図2:シゾロドプシンの構造
(左)シゾロドプシン3量体の全体構造 (右)シゾロドプシンとバクテリオロドプシンおよびヘリオロドプシンとの重ね合わせ。
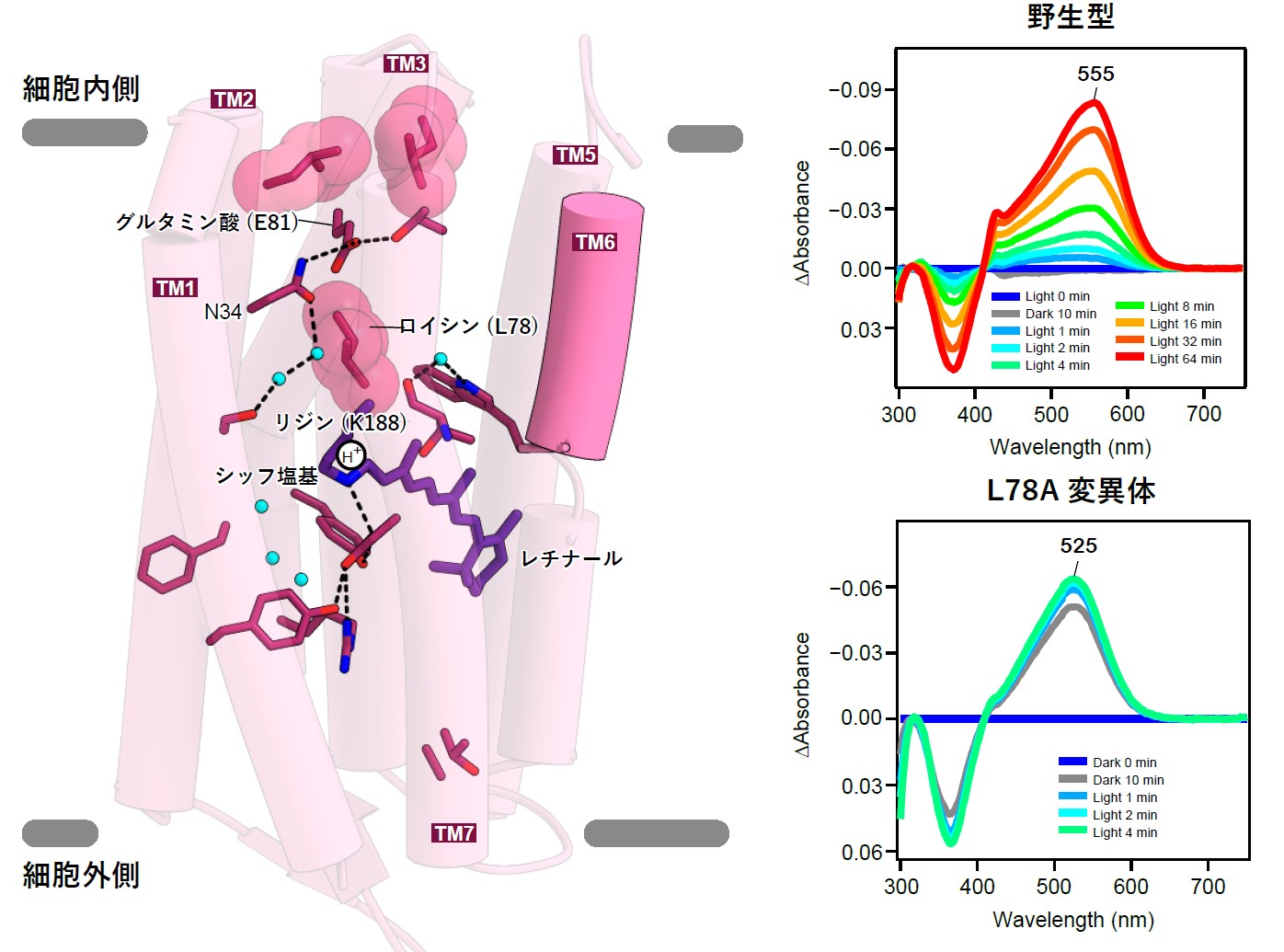
図3:細胞内側が溶媒に露出しやすいシゾロドプシンの特徴
(左)細胞内側に着目した、シゾロドプシンの水素イオン輸送経路 TM6が短いため他のロドプシンのように細胞内側を覆うことができず、グルタミン酸81(E81)は2つのロイシンによってのみ溶媒から隔たれている。シッフ塩基とE81の間には、ロイシン78が経路を塞いでおり、光活性化時はロイシン78が動くことで水素イオンが移動すると考えられる。(右)ロイシン78を改変した変異体(下)では、タンパク質内部にまで外から水や試薬が入り込み、野生型のシゾロドプシン(上)と比べて、光を当てない場合でもレチナールが容易に反応してしまうことを示すタンパク質の光吸収変化。
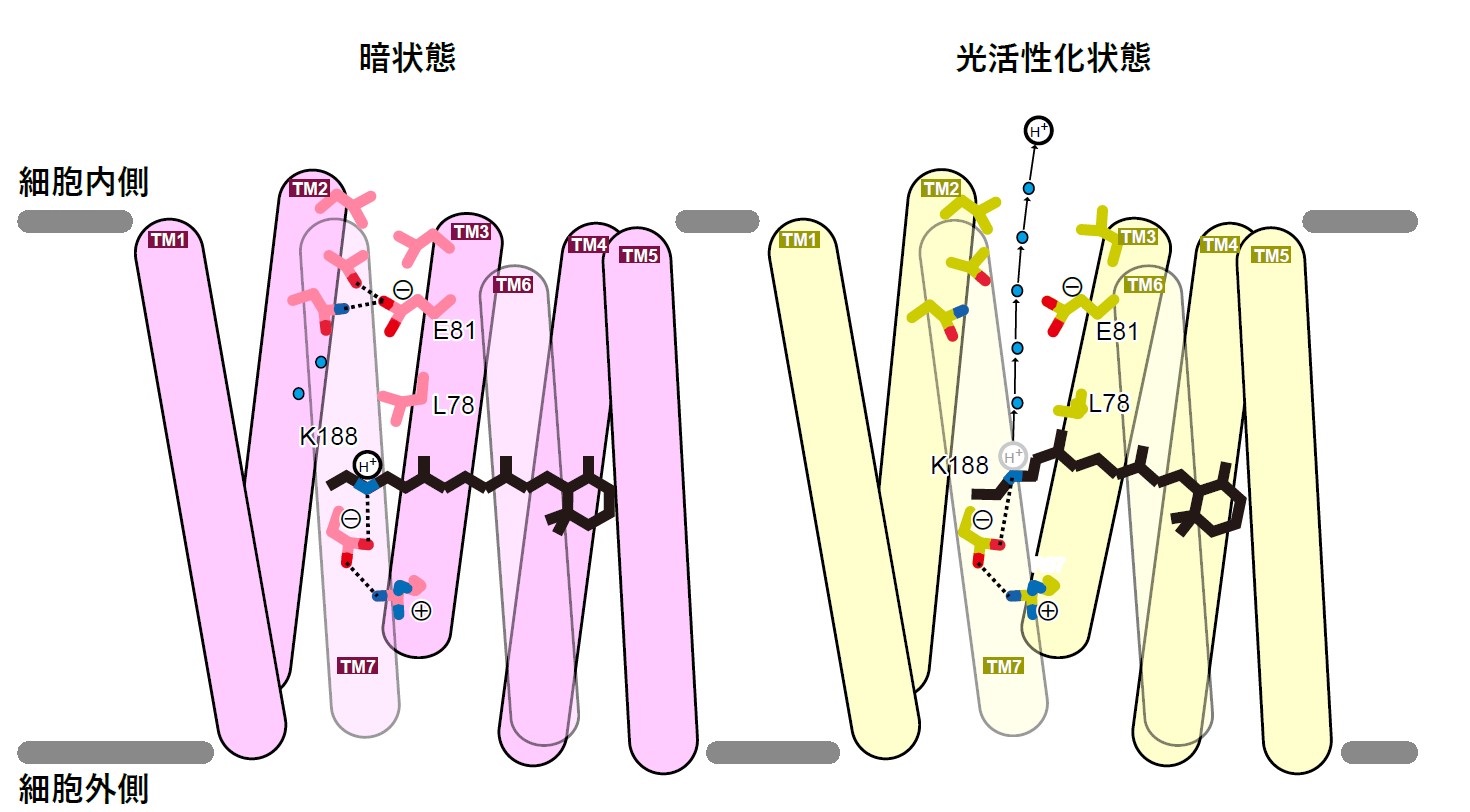
図4:シゾロドプシンの内向き水素イオン輸送モデル
骨と同じ成分からなる脱"レアメタル"触媒でSDGs達成に貢献 ー光化学オキシダントの原因となるVOCガスの分解性能を飛躍的に向上させる新たな表面活性化技術を開発ー 鉄酸鉛の特異な電荷分布を解明 ー電荷秩序が磁化の方向変化を誘起、負熱膨張への展開もー

