振動分光法を駆使した薬剤効能測定法の開発 ~アセチルコリン受容体を標的とした神経疾患の治療薬開発への期待~
News&Topics
カテゴリ:プレスリリース|2021年12月 1日掲載
名古屋工業大学
関西医科大学
東北大学
京都大学
発表のポイント
〇 全反射赤外分光法(注1)をムスカリン性アセチルコリン受容体(注2)に適用し、異なる薬剤効能(注3)を示す種々の薬物との結合に伴う受容体タンパク質の構造変化を捉えることに成功しました。
〇 各種薬物の効能と相関するアミド-I(注4)のバンド変化を得ることに成功し、この変化は細胞中のGタンパク質活性を反映することが分かりました。
〇 本研究は、ムスカリン性アセチルコリン受容体を標的とする創薬開発に貢献するとともに、薬物認識における分子機構の理解につながります。
概要
名古屋工業大学大学院工学研究科の片山耕大 助教、神取秀樹 教授、魲洸平 氏(研究当時:生命・応用化学専攻 博士前期課程2年)、関西医科大学医学部医化学講座の清水(小林)拓也 教授、寿野良二 講師、東北大学大学院薬学研究科の井上飛鳥 准教授、京都大学医学研究科の岩田想 教授らのグループは、全反射赤外分光法でGタンパク質共役型受容体(GPCR)の一つ、ムスカリン性アセチルコリン受容体(M2R)に対する、異なる薬剤効能(ligand efficacy)を有する各種薬物結合に伴う構造変化を捉えることに成功しました(図1)。そして、それぞれの赤外差スペクトル(注5)におけるアミド-Iバンドの変化が各種薬物間で分類できる可能性を見出しました。実際、細胞アッセイを用いたGタンパク質活性の大きさとアミド-Iバンドの変化との間に相関性があることが分かりました。この研究成果により、全反射赤外分光法によって得られたアミド-Iのバンド変化がM2Rのligand efficacyを決めるプローブとなり得ることを示しただけでなく、従来の構造ベースの薬物結合ポケットを基盤とした薬剤設計指針とは異なる、相互作用解析から動的構造情報を抽出し薬効度を制御する新たな薬剤設計指針を提示できると期待されます。
研究成果は、2021年11月23日にオンライン科学雑誌「Communications Biology」誌に掲載されました。
図1 溶液循環型全反射赤外分光法から得られるM2Rの異なる薬物結合誘起差スペクトル
研究の背景
Gタンパク質共役型受容体(G Protein-Coupled Receptor: GPCR)は、薬物の結合などによって引き起こされる構造変化(活性化)が細胞内へと伝わることでシグナル伝達因子(Gタンパク質/アレスチン)を介したシグナル伝達を行います(図2a)。GPCRの薬物はその生体活性によって、完全作動薬(full agonist)、飽和量薬物を投与しても部分的な活性しか示さない部分作動薬(Partial agonist)、基礎活性(薬物が結合していないGPCRが示す一定の弱い活性)を変化させない阻害薬(Antagonist)、そして基礎活性さえも抑制する逆作動薬(Inverse agonist)に分類されます(図2b)。これらの薬剤効能の違いは"ligand efficacy"と呼ばれ、薬効に影響することからも、薬物ごとにefficacyが異なる分子機構を理解することは、合理的な薬剤開発を促進させます。これまでにいくつかのGPCRについて異なるefficacyを有する薬物結合状態のX線結晶回折や低温電子顕微鏡を用いた単粒子解析によって原子レベルでの構造が決定されています。しかしながら、薬物親和性が低い天然薬物や部分作動薬など、全ての薬物がこれらの構造解析手法に適用されるわけではなく、現在も世界中の構造生物学者が奮闘しています。
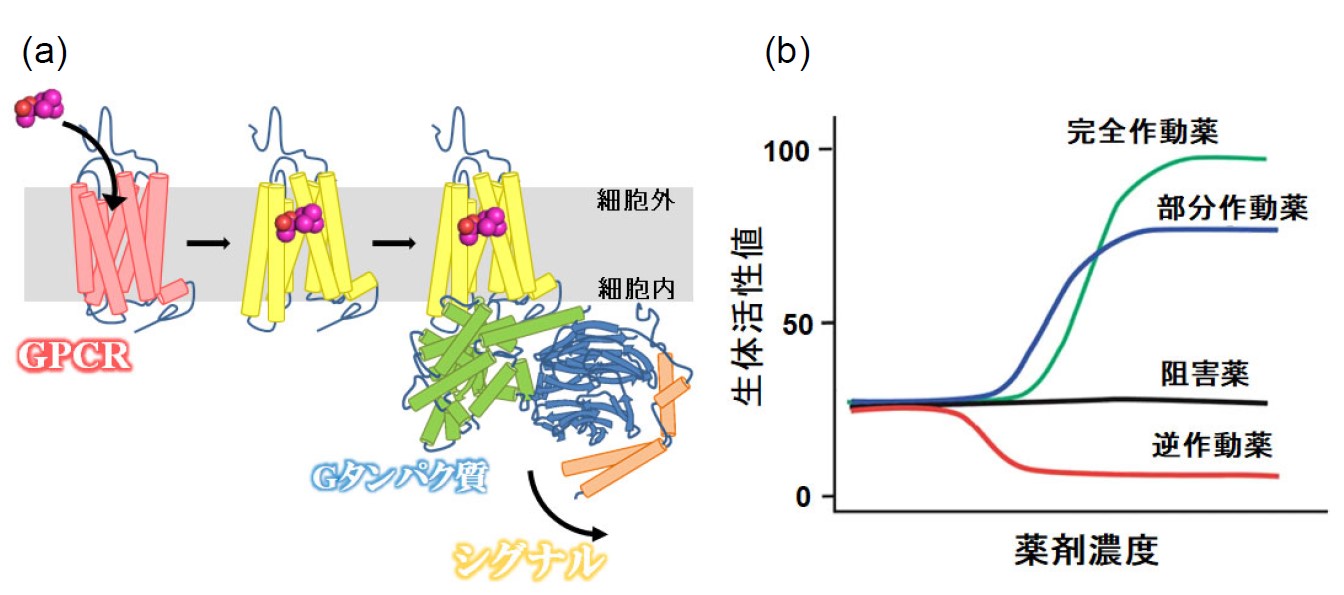
図2 (a)GPCRの薬物結合および活性化過程 (b)薬剤効能の違い(ligand efficacy)
研究の内容・成果
今回、本研究グループは、独自に開発した全反射赤外分光法と2液交換系を組み合わせた測定手法を用いて、GPCRの一つであるムスカリン性アセチルコリン受容体(M2R)に対する、異なるefficacyを有する各種薬物結合に伴う構造変化を捉えることに成功しました。その結果、得られた各種薬物結合誘起差スペクトルにおける、α-ヘリックスのC=O伸縮振動バンドに対応するアミド-Iバンドの変化が、各種リガンド間で分類できる可能性を見出しました(図3)。すなわち、観測された3つのアミド-Iバンドをそれぞれ①、②、③とおき、ピーク強度の和(①+②、②+③)をそれぞれM2Rの活性状態、不活性状態と定義付けてGタンパク質活性化度合いを算出した結果、ligand efficacyに依存した違いが生じることが分かりました(図3)。
さらに、それぞれの薬物に対し培養細胞を用いたGタンパク質活性評価(NanoBit G-protein dissociation assay)(注6)を行い、Gタンパク質活性の大きさを縦軸に、赤外分光法から得たGタンパク質活性化度合い値を横軸にプロットした結果、相関性があることが分かりました(図4)。つまり、この結果は、全反射赤外分光法によって得られたアミド-Iのバンド変化がM2Rのligand efficacyを決めるプローブとなり得ることを示しました。
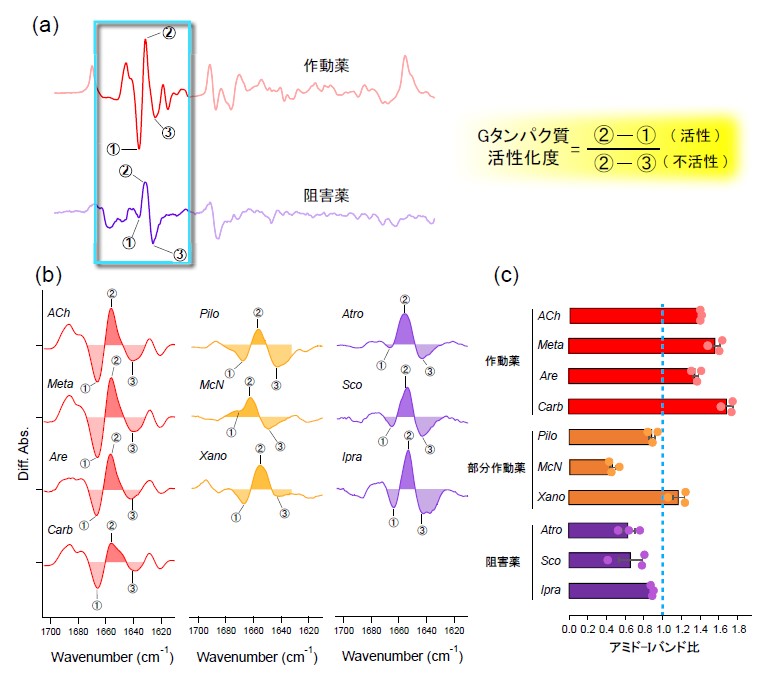
図3 (a, b, c)アミド-IバンドからのGタンパク質活性化度合いの定量解析
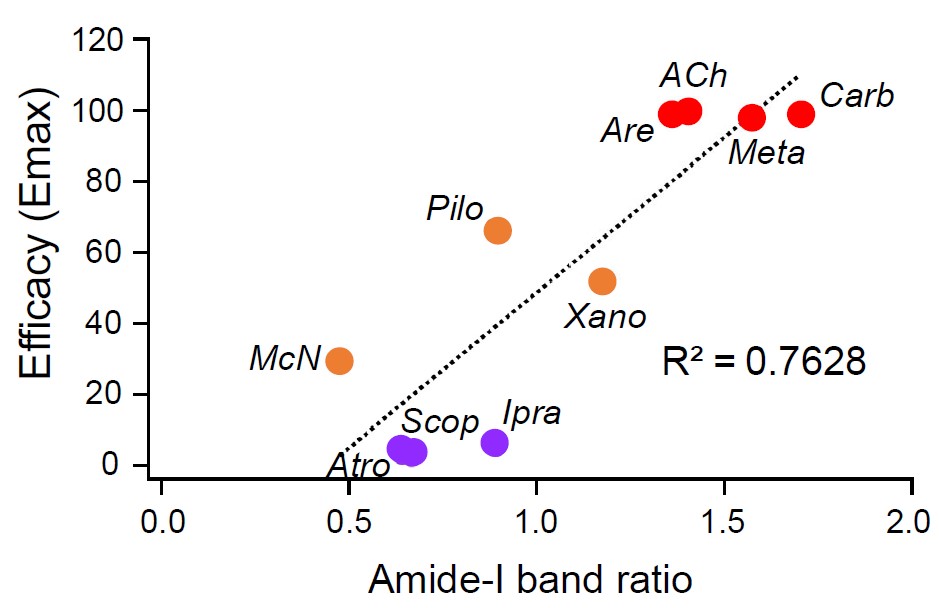
図4 アミド-Iバンドから得られたGタンパク質活性化度合いと、細胞を用いたNanoBiT Gタンパク質アッセイから得たGタンパク質活性化度合いのプロット
社会的な意義・今後の展望
本研究において、すでにX線結晶構造解析や低温電子顕微鏡による単粒子解析によって原子レベルのGPCRの静止構造が得られているGPCRであれば、赤外分光法から得られる精緻な分子間相互作用に関する構造情報と組み合わせることで、GPCRのリガンド選択性や活性化機構に対するより深い理解をもたらす相互の解析ができます。そして、従来の構造ベースの薬物結合ポケットを基盤とした薬剤設計指針とは異なる、相互作用解析から動的構造情報を抽出しシグナル選択性や薬効度を制御する新たな薬剤設計指針を提示できることが期待されます。特に、アセチルコリン受容体は5種類のサブタイプ(M1RからM5Rまで)が存在する中で、M1Rが主に脳に存在し記憶や学習に関与する一方で、今回研究対象としたM2Rは心臓に多く存在するなど、各々のサブタイプは同じ神経伝達物質であるアセチルコリンを受容しながら、固有の分布と薬理作用を持っています。従って、今回の研究を通して、サブタイプ選択的な創薬研究への貢献が期待されます。また、今回確立した計測手法はGPCRのみならず、他の薬剤標的として注目される膜タンパク質(イオンチャネルやトランスポーター)へと拡張できる可能性があります。
用語解説
注1 全反射赤外分光法
試料よりも屈折率の高いSiやダイヤモンドなどの材質からなる結晶を用い、その表面に試料を吸着させ、結晶内部で全反射となる角度で赤外線を入射させます。その際に、赤外線の反射面において結晶表面に染み出してくる近接場光(エバネッセント光)が、表面近傍に存在する試料によって吸収されます。エバネッセント光は赤外線の波長程度(3~10μm)しか表面に染み出さないため、表面近傍の赤外吸収のみを計測することを可能にしています。さらに1~5μg程度と比較的少量の試料で計測することも利点です。
注2 ムスカリン性アセチルコリン受容体
GPCRの一つで、パーキンソン病やアルツハイマー病に関わる神経伝達物質、アセチルコリンを天然リガンドとして受容する膜タンパク質です。5種類のサブタイプ(M1RからM5R)が存在しており、今回研究対象としたM2Rは、主に心臓に分布し、心臓機能を抑制的に調節しています。
注3 薬剤効能
GPCRの薬物はその生体活性によって、完全作動薬(full agonist)、飽和量薬物を投与しても部分的な活性しか示さない部分作動薬(Partial agonist)、基礎活性(薬物が結合していないGPCRが示す一定の弱い活性)を変化させない阻害薬(Antagonist)、そして基礎活性さえも抑制する逆作動薬(Inverse agonist)に分類されます。これらの薬剤効能の違いは"ligand efficacy"と呼ばれます。
注4 アミド-I
タンパク質の二次構造を構成するα-ヘリックスのペプチド結合におけるC=O伸縮振動を"アミド-Iバンド"と呼びます。一般的に1650 cm-1付近に赤外吸収を有します。
注5 赤外差スペクトル
薬物非結合状態と薬物結合状態の赤外スペクトルを差し引くことで得られるスペクトルのことを指します。薬物結合に伴う試料(タンパク質)の構造変化に由来する赤外吸収バンドが差スペクトルとして検出されます。
注6 Gタンパク質活性評価(NanoBiT G-protein dissociation assay)
生細胞でのタンパク質間相互作用検出法です。発光タンパク質ルシフェラーゼおよびその基質を改変し、両者の断片(LgBiTとSmBiT)を用いて細胞内でのタンパク質相互作用検出を可能にした技術です。GαサブユニットとGγサブユニットにそれぞれLgBiTとSmBiTを融合させて細胞内で発現させ、三量体Gタンパク質の活性化(乖離反応)を発光シグナルの減少として検出します。
論文情報
論文名:Vibrational spectroscopy analysis of ligand efficacy in human M2 muscarinic acetylcholine receptor (M2R)
著者名:Kota Katayama, Kohei Suzuki, Ryoji Suno, Ryoji Kise, Hirokazu Tsujimoto, So Iwata, Asuka Inoue, Takuya Kobayashi, Hideki Kandori
掲載雑誌名:Communications Biology
公表日:2021年11月23日
DOI: 10.1038/s42003-021-02836-1
URL: https://www.nature.com/articles/s42003-021-02836-1
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ「量子技術を適用した生命科学基盤の創出」研究領域 研究課題名「構造基盤に立脚した色認識機構および色覚情報伝達機構の解明」(JPMJPR19G4)令和元年度採択(研究者:片山耕大) および日本学術振興会における科学研究費助成事業の若手研究 (研究代表者:片山耕大)、基盤研究 (B) (研究代表者:片山耕大)、基盤研究 (A) (研究代表者:神取秀樹)、新学術領域研究 (研究領域提案型) (研究代表者:神取秀樹)、基盤研究 (C) (研究代表者:寿野良二)、基盤研究 (B) (研究代表者:寿野良二)、学術変革領域研究 (B) (研究代表者:寿野良二)、新学術領域研究 (研究領域提案型) (研究代表者:岩田想) および学術変革領域研究 (B) (研究代表者:井上飛鳥) の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構 (AMED)「創薬等ライフサイエンス研究支援基盤事業」および「創薬等先端技術支援基盤プラットフォーム (BINDS)」の支援により行われました。
お問い合わせ先
研究に関すること
名古屋工業大学大学院工学研究科 工学専攻生命・応用化学系プログラム
助教 片山 耕大 (かたやま こうた)
TEL:052-735-5218
E-mail:katayama.kota[at]nitech.ac.jp
名古屋工業大学大学院工学研究科 生命・応用化学専攻
教授 神取 秀樹 (かんどり ひでき)
TEL:052-735-5207
E-mail:kandori[at]nitech.ac.jp
関西医科大学医学部医化学講座
教授 清水(小林)拓也(しみず こばやし たくや)
TEL:072-804-2340
E-mail:kobayatk[at]hirakata.kmu.ac.jp
東北大学大学院薬学研究科
准教授 井上 飛鳥(いのうえ あすか)
TEL:022-795-6861
E-mail:iaska[at]tohoku.ac.jp
京都大学大学院医学研究科 分子生体統御学講座 分子細胞情報学分野
教授 岩田 想(いわた そう)
TEL:075-753-4372
Email:s.iwata[at]mfour.med.kyoto-u.ac.jp
広報に関すること
名古屋工業大学 企画広報課
TEL:052-735-5647
Email:pr[at]adm.nitech.ac.jp
関西医科大学 広報戦略室
TEL:072-804-2128
Email:kmuinfo[at]hirakata.kmu.ac.jp
東北大学大学院薬学研究科 総務係
TEL:022-795-6801
Email:ph-som[at]grp.tohoku.ac.jp
京都大学 総務部広報課国際広報室
TEL:075-753-5729
Email:comms[at]mail2.adm.kyoto-u.ac.jp
*それぞれ[at]を@に置換してください。
タングステン添加酸化スズはなぜ赤外線に対して透明なのか?~次世代太陽電池向け高移動度透明電極の新たな設計指針~ フッ素官能基を持つアルカロイド様物質の製造に成功 -創薬の成功確率を向上させる新しい化合物ライブラリーの開発-

