ロドプシンの新たな波長制御残基の発見 ~波長制御メカニズムの解明と光遺伝学応用への期待~
News&Topics
カテゴリ:プレスリリース|2023年7月 7日掲載
発表のポイント
〇 新規酵素ロドプシン8種の網羅的特性解析をもとに、これまで報告のなかった新しい波長制御残基を特定し、変異体解析により波長制御メカニズムを明らかにした。
〇 このメカニズムは、多くのファミリーを持つ微生物ロドプシン全般に応用可能であることを示した。
〇 光遺伝学で求められる波長制御されたツール開発への応用が期待される。
概要
名古屋工業大学大学院工学研究科の杉浦雅大氏(生命・応用化学専攻3年)、Manish Singh特任助教、神取秀樹特別教授らの研究グループは、微生物ロドプシンの新たな波長制御残基を特定しました。
ロドプシン内部には、光を吸収するためにレチナール(ビタミンAの類縁体)という分子が結合していますが、その吸収波長はタンパク質内部の環境によって大きく変化します。吸収波長を自在に制御することができれば、生命活動を光で制御する光遺伝学にも大きく貢献できます。自然界に存在する2つのロドプシンが同一部位に異なるアミノ酸を持っている場合、それを置換することで吸収波長が反対方向に移る部位を「色スイッチ」と呼びます。レチナールの周りには20以上のアミノ酸が存在しますが、タンパク質の構造は精密であるためアミノ酸を置換すると構造が容易に壊れてしまい、これまでに3個の「色スイッチ」しか見つかっていませんでした。
今回、本研究グループは第4の「色スイッチ」を自然界から発見しました。具体的には、新規酵素ロドプシンの解析をもとに、N/LIスイッチの存在を明らかにしたのです。N/LIスイッチにおいて、アスパラギン(N)残基では赤方向、ロイシン(L)またはイソロイシン(I)残基では青方向の吸収を示し、変異により吸収波長が逆転します。そのメカニズムは、アミノ酸の極性により説明されます。さらにN/LIスイッチは、微生物ロドプシン全体においても適用可能であることを明らかにしました。今回発見したN/LIスイッチを活用することで、光遺伝学への応用が期待されます。
本研究成果は米国化学会の雑誌「Biochemistry」誌(2023年7月 4 日付)に掲載されました。
研究の背景
動物および微生物のロドプシンは、400 ~ 700 nm の幅広いスペクトル領域の電磁波を吸収します。この領域は可視光と呼ばれ、虹の色に代表されるように紫、藍、青、緑、黄、橙、赤から構成されています。我々の目は、これらの色を識別することができますが、光を吸収するために使用している分子はレチナールという発色団(光を吸収するもの)のみです。これは、レチナールの吸収波長が、ロドプシンというタンパク質の中で厳密に制御されており、紫、藍、青、緑、黄、橙、赤に代表される様々な光(色)を認識していることを示します。
ロドプシンの吸収極大波長(λmax)は、レチナール(プロトン化されたシッフ塩基を保持)がもつ電子基底状態(S0)と第一励起状態(S1)の間のエネルギー差によって決まります(図1)。このエネルギー差に相当する光を吸収するとS0からS1状態に励起され、分子の機能が開始されます。S0状態ではレチナール発色団の正電荷はシッフ塩基結合上(窒素原子の部分)に局在しますが、S1状態ではβ-イオノン環に向かって非局在化します(図1a右)。このときエネルギーギャップの大きさが、レチナール近傍に存在する電荷によって変化することが知られており、ロドプシンの吸収波長が制御されています(図1a左)。具体的には、シッフ塩基の近くに負電荷があると正負電荷の相互作用によりS0状態が安定化されるため、S0-S1間のエネルギーギャップが大きくなります(図1b)。可視光では紫(400 nm)に近いほどエネルギーが大きいため、この場合は吸収波長が短波長シフトします。逆にβ-イオノン環の近くに負電荷があると、S1状態が安定化されるため、S0-S1間のエネルギーギャップが小さくなり、吸収波長は長波長シフト(より赤色に近い色)を吸収するようになります(図1c)。実際に、人間の赤 (λmax: 560 nm) と緑 (λmax: 530 nm) の色識別は、β-イオノン環の近くにある 3 つの O-H基(弱い負電荷)をもつアミノ酸残基によって実現されることが明らかとなっています。この規則は一般にすべてのロドプシンに当てはまります。
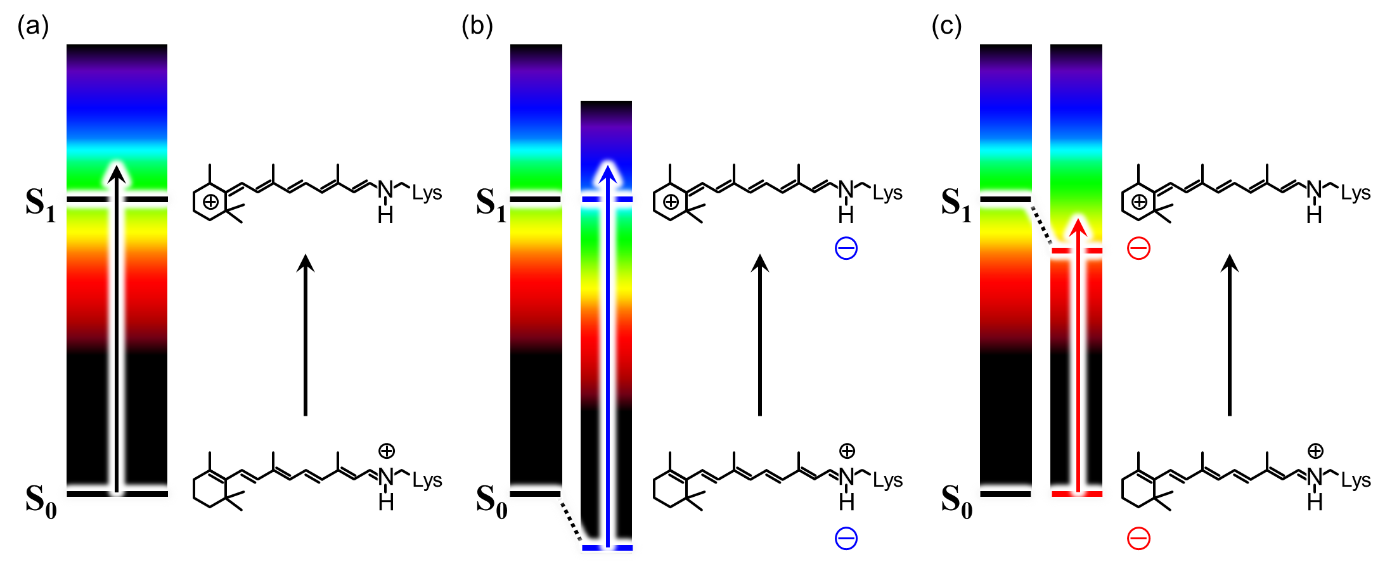
図1 ロドプシンの吸収波長調節の原理
この法則に従って変異体を作れば、簡単に吸収波長を制御可能に見えますが、タンパク質は精密に設計されており、変異を加えると容易にタンパク質とレチナールの相互作用が壊れてしまいます。そのため、これまでに「色スイッチ」として認められた波長制御可能な残基は、たったの3つ(ロイシン/グルタミン・アラニン/セリン スレオニン・グリシン/プロリンの単アミノ酸変異スイッチ)しかありませんでした (図 2)。
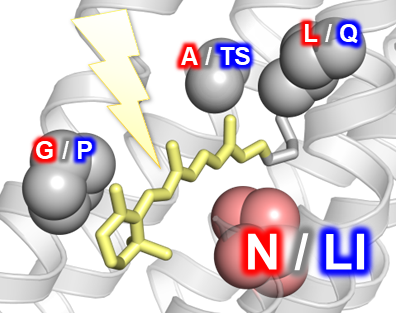
図2 既存の波長制御残基(L/Q、A/TS、G/P)と新たに見出された波長制御残基(N/LI)
研究の内容・成果
本研究グループが以前報告した新規酵素ロドプシンの研究から、上記3つとは異なる新たな波長制御残基の候補が見出されました(図2)。そのアミノ酸残基はアスパラギン(極性残基)とロイシン・イソロイシン(非極性残基)であり、β-イオノン環の近くに位置していたため、上記の法則からするとS1状態に影響を及ぼすことが予想されました。そこでロドプシンホスホジエステラーゼに単アミノ酸変異を加えることで、アスパラギンとロイシンがロドプシンの吸収波長に及ぼす影響を測定しました。一部はタンパク質が不安定となり、壊れてしまうものもありましたが、ロイシンからアスパラギンへの変異では吸収波長が長波長化し、アスパラギンからロイシン・イソロイシンへの変異では吸収波長が短波長化したため、この部位のアミノ酸残基が「色スイッチ」として吸収波長を制御していることが明らかになりました。
このメカニズムは前述の波長調節の原理でよく説明ができます。ロイシン残基は非極性側鎖を持つためレチナール分子と静電相互作用しない一方、アスパラギン残基はδ-の負電荷をもつ酸素原子がレチナールのβ-イオノン環の近くに存在することで、励起状態であるS1が安定化されてエネルギーギャップが減少し、吸収波長が長波長化すると考えられます(図3)。
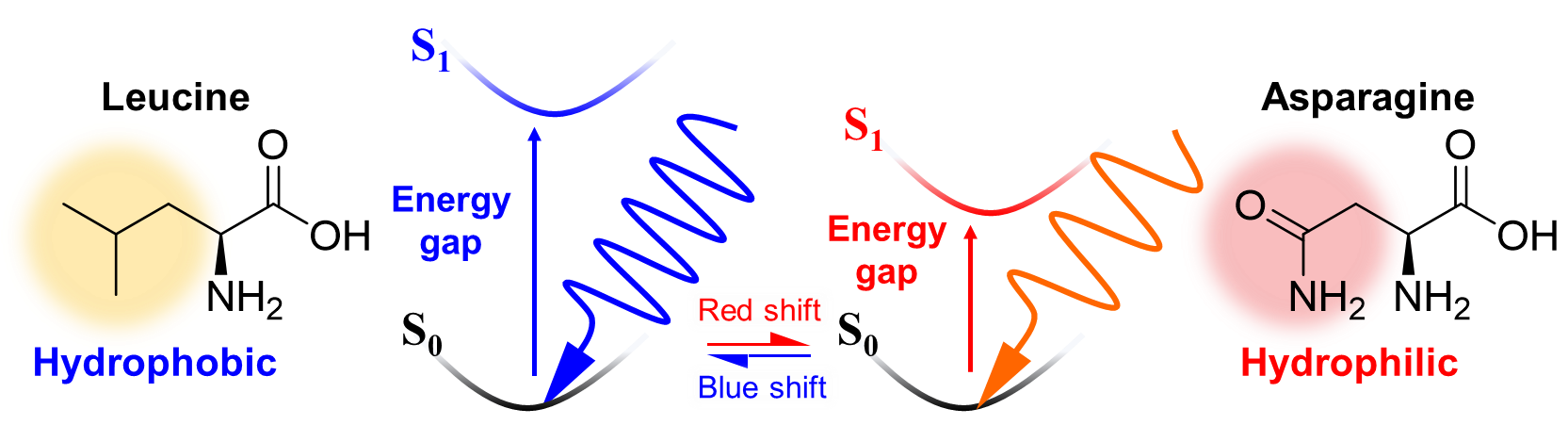
図3 アスパラギン残基とロイシン残基による波長制御メカニズム
次いで、この「色スイッチ」がロドプシンホスホジエステラーゼファミリーに限らず、微生物ロドプシン全般においても成り立つかどうかを、変異体により調べました。微生物ロドプシンの代表として、内向きクロライドポンプ(FR)、外向きナトリウムポンプ(KR2)、内向きプロトンポンプ(PoXeR)、近年発見された新たなファミリーであるヘリオロドプシン(TaHeR)を用いました。その結果、それらすべての微生物ロドプシンにおいて、この残基が「色スイッチ」としてはたらくことがわかりました。
社会的な意義・今後の展望
ロドプシンを初めて見る人の感想は「きれいな色をしていますね」といった色に関する内容がほとんどであり、研究者も同様に吸収波長がどのように制御されているのかという疑問を明らかにすべく長らく研究がされてきました。しかし、現状ではロドプシンの色は実際に発現してみなければわかりません。今後、アミノ酸配列によりロドプシンの色がわかるようになれば、様々な方面の研究への展開が期待されます。今回、吸収波長を制御している「色スイッチ」となるアミノ酸残基を明らかにしたことは、ロドプシン研究分野において大きな意義があります。
2005年に誕生した光遺伝学において、微生物ロドプシンは脚光を浴びました。光遺伝学は光受容をするタンパク質を、遺伝学を用いて目的の細胞内に発現させ、光で生体活動を制御しようとする学問であり、現在では神経生理学や、遺伝子治療分野といった幅広い研究分野で応用されています。
光で生体反応を制御するためには、吸収波長のバリエーションが求められます。例えば、機能の活性化および不活性化を異なる光で制御できれば、より使いやすいツールとなり、太陽に手をかざしたときに、赤く見えるように生体は赤色の方が透過しやすいことから、赤色で活性化できるロドプシンの方が、体内のより深部の光操作が可能となります。
そこで、今回発見した波長制御残基と同じ位置のアミノ酸が微生物ロドプシン全体でどのような性質を持つのかを遺伝子解析ソフトを用いて確かめました(図4)。すると一般的なロドプシンは、ロドプシンホスホジエステラーゼと一部のヘリオロドプシンを除くほぼすべてのロドプシンで疎水的なアミノ酸残基が保存されていました。今回の研究によって明らかとなったロイシン・イソロイシンといった非極性アミノ酸残基からアスパラギン残基へと変異を加えることで、吸収波長をより長波長化した光遺伝学ツールの創出に期待が持たれます。
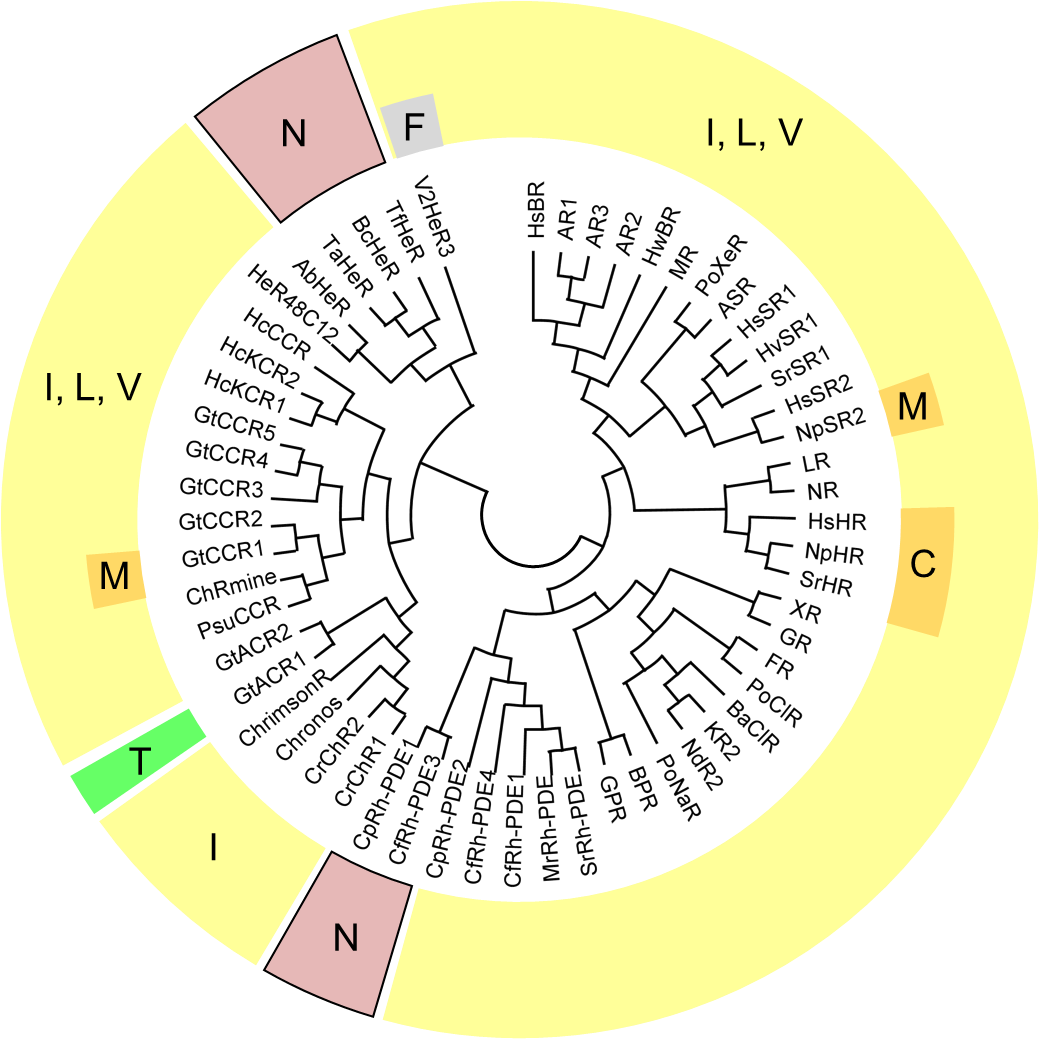
図4. 微生物ロドプシンにおける新奇波長制御残基位置のアミノ酸保存性
本研究ではロドプシン研究分野にとどまらず、現在飛躍的に研究が進んでいる光遺伝学に直接応用可能な知見をもたらし、今後の研究の広がりが期待できます。
本研究成果は、日本学術振興会の特別研究員奨励費、科学研究補助金(特別推進研究)、科学技術振興機構(戦略的創造研究推進事業 CREST「光の特性を活用した生命機能の時空間制御技術の開発と応用」)の支援を受けて行われました。
論文情報
論文名:A Novel Color Switch of Microbial Rhodopsin
著者名:Masahiro Sugiura, Manish Singh, Satoshi P. Tsunoda, Hideki Kandori
掲載雑誌名:Biochemistry
公表日:2023年7月 4 日(米国時間)
DOI(Digital Object Identifier) :10.1021/acs.biochem.3c00131
URL :https://pubs.acs.org/doi/10.1021/acs.biochem.3c00131
お問い合わせ先
研究に関すること
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
オプトバイオテクノロジー研究センター
特別教授 神取 秀樹
TEL:052-735-5207
E-mail:kandori[at]nitech.ac.jp
広報に関すること
名古屋工業大学 企画広報課
TEL:052-735-5647
Email:pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
【2024年4月】ドイツ・エアランゲンニュルンベルク大学(FAU)と共同で 「国際連携エネルギー変換システム専攻」を開設! ―カーボンニュートラル社会の実現に向けて、新たな価値を創造し、協奏的に社会を変革できる人材を育成― 中赤外ハイパースペクトルイメージングを桁違いに高速化 ―動的変化も測定可能、がん組織の高速診断応用に期待―

