網膜色素変性症の治療につながる低分子抗体を発見 ~抗体を基盤とした網膜疾患の新たな遺伝子治療法の確立に向けて~
News&Topics
カテゴリ:プレスリリース|2023年9月19日掲載
発表のポイント
〇 眼の中で光受容機能を担うタンパク質(ロドプシン(注1))を特異的に認識する、ナノボディ(注2)と呼ばれるラマ由来の特殊な抗体を発見し、ロドプシンとナノボディとの複合体の立体構造を、X線結晶構造解析(注3)を用いて解明しました。
〇 ナノボディが、ロドプシンのタンパク質変性(ミスフォールディング(注4))と過剰な光活性化(常時活性)(注5)を阻止できることを明らかにしました。
〇 ナノボディは、中心視力や夜間視力、色覚の低下を引き起こす網膜色素変性症(注6)の治療法開発の促進につながることが期待されます。
概要
名古屋工業大学大学院工学研究科の渡辺航平氏(研究当時:工学専攻生命・応用化学系プログラム 博士前期課程2年)、神取秀樹 特別教授、片山耕大 准教授らの研究グループは、アメリカ・カリフォルニア大学アーバイン校のクリストフ・パルチェフスキー特別教授らの研究グループとの国際共同研究により、ロドプシンを特異的に認識する、ナノボディと呼ばれるラマ由来の特殊な抗体を発見しました。さらに、ロドプシンにナノボディが結合した複合体の立体構造を、X線結晶構造解析により解明し、種々の分光計測手法および生化学的手法を組み合わせることで、ナノボディが、ロドプシンのミスフォールディングと過剰な光活性化を阻止できることを明らかにしました。ロドプシンは、ヒトの眼の網膜における重要な光感受性分子であり、ロドプシン遺伝子の突然変異によって光受容機能が低下する、網膜色素変性を発症する恐れがあることから、今回発見したナノボディが、網膜色素変性症の治療法開発の促進につながることが期待されます。
本研究成果は、2023年8月29日に米国科学誌「Nature Communications」誌に掲載されました。
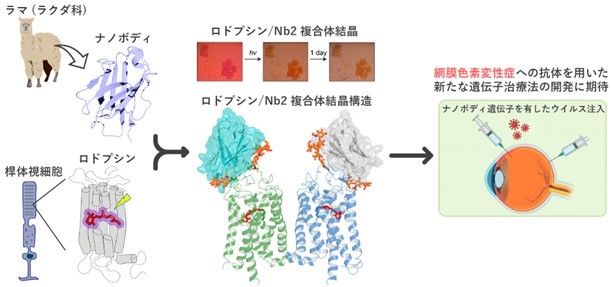
本研究成果の概要
研究の背景
網膜色素変性症は、眼の奥の網膜に異常をきたす遺伝性かつ進行性の眼疾患群です。日本では4000-8000人に1人が発症すると推定されており、夜盲、視野狭窄、視力低下が特徴的な症状です。網膜の中には光受容細胞として知られる、桿体視細胞と錐体視細胞の2種類が存在し(注7)、それぞれ我々の明暗視、色覚を担います。網膜色素変性症はこれら2種類の視細胞のうち桿体が主に障害されることによって引き起こされることが多く、暗いところで物が見えにくくなったり(夜盲)、視野が狭くなったりするような症状を最初に起こします。そして病気の進行とともに錐体も障害され、視力低下を自覚するようになります。現在、網膜色素変性症の根本的な治療法は確立されておらず、遺伝子治療や神経保護、細胞移植などの研究が世界中で盛んに行われている状況です。
ロドプシンは、桿体視細胞に含まれる、光受容機能の根源を担う分子であり、ロドプシンにおける様々な遺伝子変異が原因で網膜色素変性を発症すると考えられています(図1)。網膜色素変性症の患者において、150以上のロドプシン遺伝子の変異が確認されており、これらロドプシン遺伝子の変異によってタンパク質のミスフォールディングや、光刺激に関係なく恒常的にロドプシンが活性化してしまう異常など、ロドプシン遺伝子の変異箇所の違いによって異常形態も多様化していることが、特定の標的遺伝子治療の開発を困難にしていると考えられています。
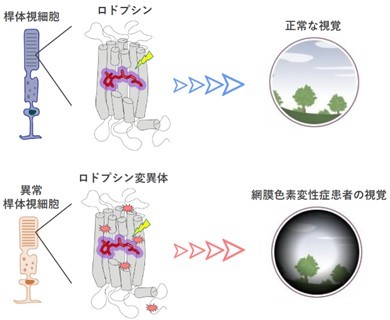
図1 ロドプシン変異体による網膜色素変性の発症
また、ロドプシンを標的とした創薬や遺伝子治療法の開発に向けては、ロドプシンの光受容機能を支える分子基盤を解明することが重要になります。ロドプシンはGタンパク質共役型受容体(GPCR(注8))ファミリーに属するが、GPCRの中でも最初にX線の結晶構造が決定された分子で、種々の分光解析や機能解析、計算科学的解析など、機能発現の分子機構に関する研究が最も進んでいる分子ですが、その全容までは明らかにされていないのが現状です。例えば、ロドプシンによる視覚の機能発現において、光反応過程で生理的に重要と考えられているミリ秒から秒の時間領域では、メタロドプシンI(メタI)と活性中間体メタロドプシンII(メタII)がpH平衡の関係にあるが、立体構造が解明されているのはメタIIのみで(メタIに至るまでに生成する光反応中間体の構造は決定されている)、メタIIを形成するまでのタンパク質内部で起こる分子機構の理解は遅れています。活性化に至るまでの全ての構造が解明され、構造基盤に立脚した活性化の分子機構の理解が深まれば、ロドプシンの過剰な活性が原因で進行する、桿体視細胞の変性を阻止できる創薬および遺伝子治療の研究につながることが期待されます。さらに、上述の通り、ロドプシンはGPCRの中で最も分子機構解明に向けた研究が進んでいる分子であることからも、GPCRの活性・不活性化を制御する新たな薬剤設計指針を提示することも可能になるかもしれません。
研究の内容・成果
今回、本研究グループは、ロドプシンの光活性化過程で生成する中間体のうち、未だ立体構造が解明されていない、メタI中間体の高分解能構造決定に向けて、ロドプシンの光活性化過程を停止させ、メタI中間体の立体構造解析を可能にする、ナノボディとして知られる特殊なタイプのラマ由来抗体を獲得することに成功しました。具体的には、ラマから産生した、ウシ由来のロドプシンを抗原とする30種類のナノボディ低分子抗体を、ELISA法(enzyme linked immunosorbent assay法(注9))によって同定した後、光存在/非光存在の条件下において、共免疫沈降法(注10)、Blue-Nativeポリアクリルアミドゲル電気泳動法(注11)および表面プラズモン共鳴分光法(注12)を用いたロドプシンとナノボディとの結合親和性を評価する実験を通じて、最終的に、光存在下でのみ特異的かつ強固にロドプシンに結合する4種類のナノボディ低分子抗体を獲得することに成功しました (図2a)。
そこで、得られた4種類のナノボディとロドプシンを光存在下で混和させた後、X線結晶構造解析を試みることで、うち1種類のナノボディとロドプシンとの複合体(ロドプシン-ナノボディ複合体)の立体構造を3.7 Å(1 Åは100億分の1 m)の分解能で解明することに成功しました(図2b)。得られたロドプシン-ナノボディ複合体は、二量体を形成していました。また、ナノボディはロドプシンの細胞外側の第2ループ(注13)を含む表面領域を幅広く認識するように結合していました。特に、ナノボディ低分子抗体の超可変領域であるCDR1とCDR3(注14)がロドプシンの細胞外第2ループのアミノ酸と静電的かつ分子間相互作用を介して結合していることが明らかとなりました(図2c)。さらに、ナノボディのCDR1およびCDR3領域のアミノ酸変異実験により、ロドプシンとの結合に特に重要なアミノ酸を特定することにも成功しました。
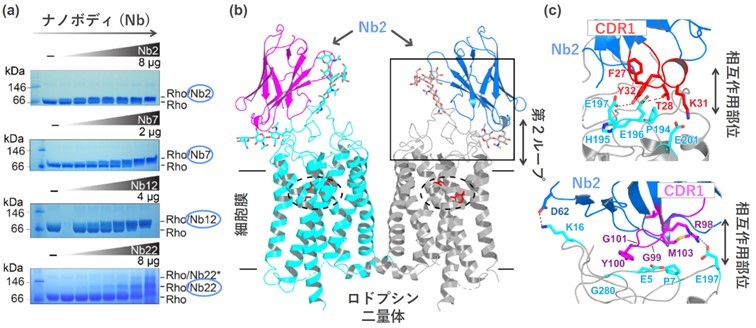
図2 (a)ゲル電気泳動によるナノボディ結合実験
(b)ロドプシンとナノボディとの複合体のX線結晶構造
(c)ナノディの超可変領域CDR1とCDR3
次に、ロドプシン-ナノボディ複合体構造がどの中間体状態を取っているかを明らかにするため、紫外可視吸収分光および透過型赤外吸収分光計測手法を用いた解析を行い、ロドプシン-ナノボディ複合体がルミ/メタI様の中間体であることを明らかにしました(図3a)。つまり、期待通り、獲得したナノボディはロドプシンの光活性化を阻害し、活性前駆体を構造的に安定化することが分かりました。さらに本研究グループは、ナノボディがどのようなメカニズムでロドプシンの活性化を阻害しているのかを明らかにするため、蛍光分光計測手法と液体クロマトグラフィー質量分析法を組み合わせた解析を行うことで、ナノボディの結合によって、ロドプシン内部に結合したレチナールシッフ塩基の加水分解反応が阻害されていることを明らかにしました(図3b)。一般に、ロドプシンは光を吸収する前の始状態において、レチナールシッフ塩基は正電荷を帯びており、近傍に存在する負電荷を帯びたグルタミン酸との静電相互作用によって安定化されていますが、光活性化時に、シッフ塩基のプロトンが脱離することで、細胞質側領域の構造変化を誘発します。その後、脱プロトン化したシッフ塩基は加水分解反応の影響を受け、ロドプシンのタンパク質内部からレチナールが解離します。今回、ナノボディが、ロドプシンの細胞外側第2ループに結合することで、レチナール結合部のタンパク質環境が安定化され、プロトンの脱離反応が抑制された結果、光活性化が阻害されたと解釈されます。
また、本研究グループは、ナノボディがロドプシンのミスフォールディングを阻害する役割も果たすのではないかと仮説を立てました。そこで、ロドプシンのミスフォールディングが原因で網膜色素変性症を引き起こすことが知られている、ロドプシンP23H(23番目のプロリン残基がヒスチジン残基に変異)変異体に対するナノボディの阻害効果を、免疫蛍光染色によるイメージング(注15)を用いて解析を行いました。ロドプシンP23H変異体はタンパク質のフォールディング過程で異常が生じ、細胞膜まで正しく輸送されず小胞体に局在することで、桿体視細胞の変性につながり、最終的には網膜色素変性を発症すると考えられています。期待通り、ロドプシンP23H変異体とナノボディを共発現させた哺乳類細胞(HEK293細胞)では、野生型と同程度のロドプシンP23H変異体の細胞膜への発現が確認され、ナノボディがロドプシンP23H変異体のミスフォールディングを阻害したことで、正しく細胞膜へ輸送されたことを示しました。以上の結果より、今回獲得したナノボディは、ロドプシンの光活性化のみならず、ミスフォールディングを阻害することが明らかになりました。
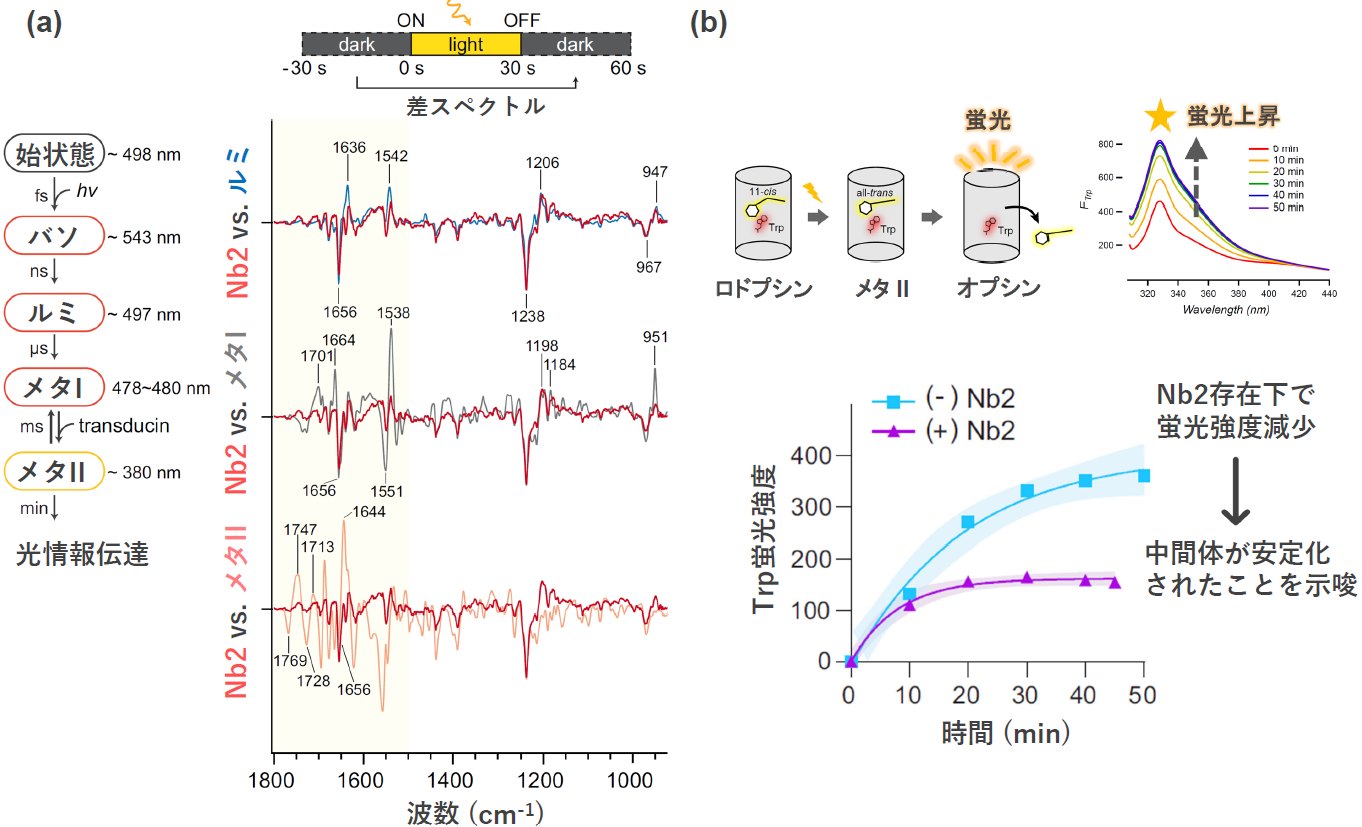
図3 (a)ナノボディ存在下でのロドプシンの光誘起赤外差スペクトル
(b)ナノボディ存在下でのロドプシンの蛍光分光測定による退色評価
社会的な意義・今後の展望
今回、ロドプシンにおいて唯一立体構造が解明されていなかった、メタI中間体様の構造を決定したことで、活性化に至るまでの分子機構の一端が明らかになりました。特に、従来、細胞外側におけるレチナールを結合させる部位の変化は、続く光反応過程で情報伝達に重要な細胞質側領域に伝わることが知られていましたが、今回の研究によって、細胞外側領域に存在する自由度の高いループ構造がアロステリックに細胞質側領域の大きな構造変化を制御していることが示唆されました。これによって、GPCRを標的とした創薬研究に新たな設計指針を与えることが期待されます。また、今回の研究対象であるナノボディ低分子抗体は、分子量が小さく、安定で可溶性であることから、通常の抗体が一般に接近できないエピトープ(抗原内で抗体が結合する部位)を認識でき、通常の抗体に代わる有望な抗体治療薬として注目されています。実際に、本研究グループは、ナノボディ低分子抗体を遺伝学的に、網膜色素変性症モデル動物マウスに導入する研究を開始しており、桿体視細胞の細胞死抑制や視力改善について、評価をしていく予定です。また、本研究成果は、将来的に、未だ治療法が確立していない、網膜色素変性症の遺伝子治療を可能にすることが期待されることから、Nature Communication誌のEditor's Highlightsに選出された他、アメリカの多くのメディアでも取り上げられました(以下URLを掲載)。
・NEI Research News on August 31, 2023 : https://www.nei.nih.gov/about/news-and-events/news/uc-irvine-researchers-discover-nanobody-which-may-lead-treatment-retinitis-pigmentosa
・Ophthalmology Times on Set 1, 2023 : https://www.ophthalmologytimes.com/view/uc-irvine-researchers-discover-a-nanobody-which-may-lead-to-treatment-for-retinitis-pigmentosa
・Ophthalmology Breaking News on August 31, 2023: https://ophthalmologybreakingnews.com/researchers-discover-a-nanobody-for-treatment-of-retinitis-pigmentosa-
・EyeWire News on Set 1, 2023:
https://eyewire.news/news/uc-irvine-researchers-discover-a-nanobody-which-may-lead-to-treatment-for-retinitis-pigmentosa
・OPP.Today (Canadian), Mirage News (Austrailian), Amplify Eyecare, Futurity, Newsbreak, Newswise, Phys.org, Technology Networks, ISP Today, CityLife and others.
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ「量子技術を適用した生命科学基盤の創出」研究領域 研究課題名「構造基盤に立脚した色認識機構および色覚情報伝達機構の解明」(JPMJPR19G4)令和元年度採択(研究者:片山耕大)、科学研究費補助金(特別推進研究)の支援を受けて行われました。
用語解説
(注1)ロドプシン
眼の網膜に存在する、明暗視を担う桿体視細胞に含まれる、光受容タンパク質を、桿体視物質あるいはロドプシンと呼びます。ヒトを始めとした様々な生物より、万を超える分子が見出されています。7回膜貫通型のタンパク質構造をもち、タンパク質内部に発色団としてビタミンAの誘導体であるレチナールを結合しています。
(注2)ナノボディ
標的抗原に結合する、重鎖のみから成る免疫グロブリン(抗体)の可変領域です。低分子抗体の一種で、単鎖抗体、単一ドメイン抗体などと呼ばれることもあります。アルパカやラクダ、ラマなどラクダ科の哺乳類は、生体内で軽鎖の無い、重鎖のみから成る免疫グロブリンを産生することが知られています。
(注3)X線結晶構造解析
結晶構造へと入射したX線が多数の特定の方向に回折する性質を用いて、結晶の原子構造や分子構造を決定する解析手法です。結晶内の原子の平均位置、化学結合、結晶学的無秩序などのさまざまな情報を決定できます。
(注4)ミスフォールディング
タンパク質は、アミノ酸が三次元的に折りたたまれることによって特有の立体構造(ネイティブ構造)を形成して機能を発揮します。一方で、タンパク質が正しくフォールディングできない、あるいは一旦正しくフォールディングしたタンパク質のネイティブ構造が変性(ミスフォールディング)することにより病気を発症することがあります。アルツハイマー病やパーキンソン病などの、疾患原因として知られています。
(注5)過剰な光活性化(常時活性)
ロドプシンは光吸収に伴い、タンパク質部分の構造変化を経て、活性化することで、光情報を伝達しますが、光刺激がなくても活性化しまい、情報を伝達してしまう状態になることを常時活性、あるいは構成的活性と呼びます。常時活性は、光情報のオンとオフの区別ができなくなり、夜盲症や網膜色素変性症の原因となります。
(注6)網膜色素変性症
遺伝子の異常により眼の中で光を感じる網膜に異常をきたす遺伝性、進行性の病気です。発症率は4000-8000人に1人とされています。症状として夜盲、視野狭窄、羞明などがあげられ、病気の進行とともに視力が低下してきます。
(注7)桿体視細胞と錐体視細胞
動物の網膜には、桿体と錐体の2種類の視細胞が存在します。いずれも光を検出して神経情報に変換する働きをしている細胞であり、互いによく似ている細胞です。光に対する応答の仕方には2つの点で大きな違いがあります。1点目は、光に対する感度の違いで、錐体よりも桿体の方が著しく光感度が高いです。このため、我々は暗いところで桿体を使って物を見ることができます。2点目は光応答の持続時間の違いです。同じ光刺激に対して、錐体は桿体より短く応答します。このため、錐体が働く明るい光環境下では、より高い時間分解能で光刺激の変化を見ることができます。応答の異なる2種類の視細胞を使い分けることによって、我々は様々な光環境で物を見ています。
(注8)Gタンパク質共役型受容体(GPCR)
細胞膜に存在する7回膜貫通型タンパク質であり、最大のファミリー(ヒトでは約800種)を形成するタンパク質として知られています。GPCRは細胞外の特定の薬剤やリガンドのみにより活性化し、膜貫通部位の構造変化により細胞内の三量体Gタンパク質を活性化可能な状態にします。ヒトのほぼすべての生命現象の制御を担うことから、GPCRを標的とした薬剤は既存医薬品の30 %以上を占めています。
(注9)ELISA法(enzyme linked immunosorbent assay法)
抗体を用いて標的分子を定量する、酵素免疫アッセイ(EIA)の一種です。抗体は、ペプチド、タンパク質、抗体、低分子などの標的分子を特異的に認識するために使われます。ELISAの特徴として、溶液中のサンプルを、シグナルを増幅しつつ検出する点が挙げられます。
(注10)共免疫沈降法
関連タンパク質間の生理的な相互作用を同定するための一般的手法です。標的タンパク質に結合したタンパク質を間接的に取得するために、標的タンパク質特異的抗体を用います。取得されたタンパク質複合体を解析して、標的タンパク質の新たな結合パートナー、結合親和性、結合様式および機能の同定が行えます。
(注11)Blue-Nativeポリアクリルアミドゲル電気泳動法
Blue-Nativeポリアクリルアミドゲル電気泳動法(BN-PAGE)はNative PAGEの一つであり、複合体構造をとるタンパク質および膜タンパク質複合体の大きさや分子種を調べるうえで有用な手法です。通常のSDS-PAGEでは変性状態のタンパク質を分離するのに対し、BN-PAGEではタンパク質の高次構造や複合体構造を保持したまま分子の大きさに従って分離することができます。さらに、二次元眼の電気泳動(SDS-PAGE)を行うことで、標的として複合体に含まれる個々のタンパク質組成についても調べることが可能になります。
(注12)表面プラズモン共鳴分光法
表面への分子の吸脱着挙動を金属表面近傍の屈折率変化として非標識かつリアルタイムで追跡できる研究手法です。吸着分子の膜厚(吸着量)を測定できるほか、リアルタイム計測結果から吸着・脱着速度など速度論的解析も行うことができます。
(注13)ループ
タンパク質の一次構造であるポリペプチド鎖は、主鎖のN-H基とC=O基との間に水素結合を形成することにより、らせん状やシート状の二次構造をとります。このうち、らせん状の構造をαヘリックス構造と呼びます。また、水素結合を形成しない場合は、ひも状のループ構造をとります。
(注14)超可変領域であるCDR1とCDR3
CDR領域とは抗体分子の可変領域で抗原と直接接触する領域で重鎖(VH)、軽鎖(VL)に3つずつ(CDR1, CDR2, CDR3)存在し、その中でもCDR3は結合に最も関与していると考えられています。CDRは抗体の抗原認識部位であるため、抗体間でアミノ酸配列が大きく異なり超可変領域とも呼ばれています。
(注15)免疫蛍光染色によるイメージング
蛍光標識抗体を用いたイメージング、免疫蛍光染色(Immunofluorescence: IF)は、固定化した細胞や組織内の標的タンパク質の局在性、相対的な発現、活性化状態を研究するために抗体と蛍光検出を使用します。具体的には、①解析対象のタンパク質を発現する細胞や組織、②解析対象のタンパク質の発現や活性を変化させる要因、③解析対象のタンパク質の細胞や組織内の局在性、④異なる解析対象タンパク質の細胞や組織構造内における空間的関連性、などを調べることができます。
論文情報
論文名:Structural basis for the allosteric modulation of rhodopsin by nanobody binding to its extracellular domain
著者名:Arum Wu, David Salom, John D. Hong, Aleksander Tworak, Kohei Watanabe, Els Pardon, Jan Steyaert, Hideki Kandori, Kota Katayama*, Philip D. Kiser*, Krzysztof Palczewski*
*責任著者
掲載雑誌名:Nature Communications
公表日:2023年8月29日
DOI: doi.org/10.1038/s41467-023-40911-9
お問い合わせ先
研究に関すること
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
准教授 片山 耕大
TEL: 052-735-5218
E-mail: katayama.kota[at]nitech.ac.jp
名古屋工業大学大学院工学研究科 工学専攻(生命・応用化学領域)
特別教授 神取 秀樹
TEL: 052-735-5207
E-mail: kandori[at]nitech.ac.jp
広報に関すること
名古屋工業大学 企画広報課
TEL:052-735-5647
Email:pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
紫外線損傷DNAを修復するDNA(DNA酵素)の構造を解明 太陽光水素生成と電池発電を繰り返せるヨウ化水素(HI)サイクル ―カーボンニュートラル実現に必要なグリーン水素を高効率生成―

