たった1つの水素結合が新型ロドプシンの光活性化反応を調節することを解明! ~新たな光遺伝学ツールの開発の鍵となる水素結合の発見~
News&Topics
カテゴリ:プレスリリース|2024年6月20日掲載
発表のポイント
〇 たった一つの水素結合の有無がヘリオロドプシン(注1)の光活性化状態の形成・崩壊の速度を調節していることを解明。
〇 これまで手の届かなかったマイクロ秒の時間領域のタンパク質の構造変化を捉えることに成功。
〇 ヘリオロドプシンを用いて光で生物の代謝や物質輸送などを制御するオプトジェネティクス(光遺伝学)(注2)ツールの開発につながる成果。
概要
名古屋工業大学大学院工学研究科の中村敏規氏(工学専攻生命・応用化学系プログラム 博士前期課程2年)、古谷祐詞准教授(工学専攻(生命・応用化学領域)・オプトバイオテクノロジー研究センター)、神取秀樹特別教授(工学専攻(生命・応用化学領域)・オプトバイオテクノロジー研究センター長)らの研究グループは、本学が国際共同研究により、2018年に発見し、Nature誌に報告したヘリオロドプシンの光活性化反応を調節する鍵となる水素結合を解明しました。ヘリオロドプシンは水素イオン輸送、グルタミン合成酵素の光制御、光修復酵素の活性化、ABC輸送体の光制御など様々な機能を発現することが報告されています。機能発現の調節には、特に光反応で形成されるO中間体と呼ばれる活性中間体の寿命が重要と考えられていますが、今回、3番目のヘリックスに存在するセリン残基と4番目のヘリックスに存在するアスパラギン残基が形成する水素結合が決定的な役割を果たすことを明らかにし、それぞれのアミノ酸残基の一文字表記(セリンはS、アスパラギンはN)から、SNapボンドと命名しました。また、量子カスケードレーザーを用いたデュアルコム分光法により、SNapボンドによりヘリックス構造の歪みが生じ、O中間体の形成や崩壊を速めていることも明らかにしました。SNapボンドの有無によりヘリオロドプシンの活性化状態の調節を可能とし、新規オプトジェネティクスツールの開発につながる研究成果です。本研究は、2024年6月14日に分子生物学分野の国際誌「Journal of Molecular Biology」誌に掲載されました。
研究の背景
ロドプシンは7回膜貫通αヘリックスからなり、内部にレチナール発色団を結合した光受容タンパク質です。視覚や概日リズムを担う動物ロドプシンと、細菌や藻類などの微生物においてイオン輸送、光センサー、光開閉チャネル、光制御酵素などの機能をもつ微生物ロドプシンに大別されていました。2018年に神取特別教授とイスラエル工科大学との国際共同研究グループが、新たなロドプシンであるヘリオロドプシンを発見しました。微生物ロドプシンと比較してアミノ酸配列の一致度が低く、脂質膜中での配向が逆転しているなどの相違点が挙げられ、生物の新たな光利用戦略を担っている可能性を示す発見となりました。2019年にはX線結晶構造解析により、原子レベルでの立体構造情報を明らかにしました。その後、2022年に光で水素イオンを輸送するヘリオロドプシンを発見し、他の研究グループからもグルタミン合成酵素の光制御、光修復酵素の活性化、ABC輸送体の光制御などの多様な機能が報告されました。レチナールの光異性化によって形成される反応中間体の中でもO中間体が重要であり、その形成に伴う構造変化によりタンパク質の活性制御を行っていると考えられています(図1)。ヘリオロドプシンの光反応機構を解明するためにはO中間体の形成・崩壊過程が鍵となると考えられてきました。
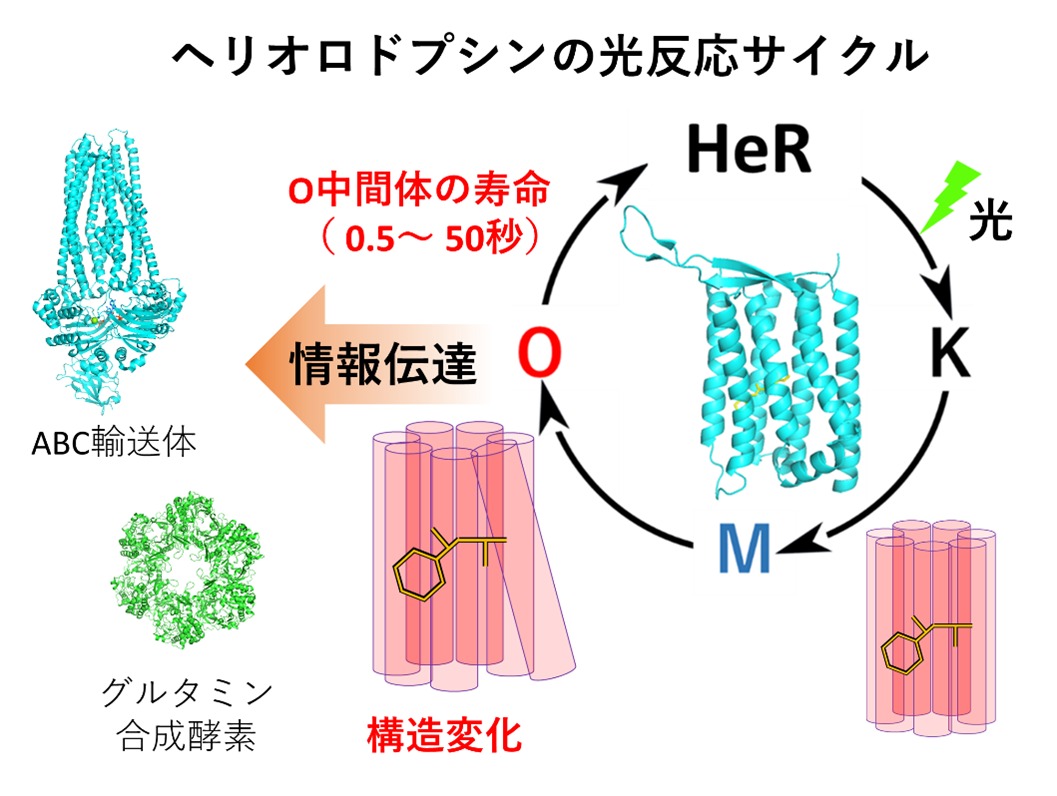
図1 ヘリオロドプシンの光反応サイクル
研究の内容・成果
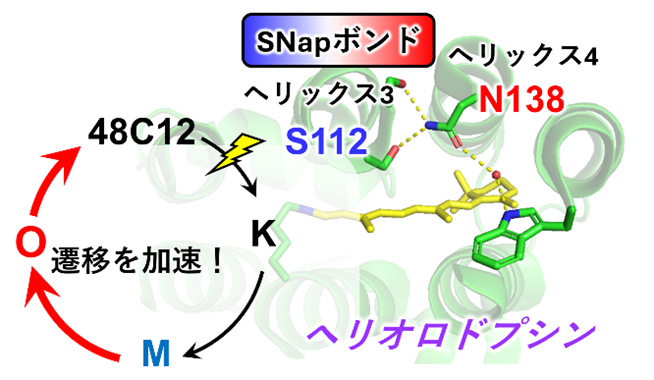
本研究グループは、2018年に最初に報告したヘリオロドプシン(48C12)と2019年にX線結晶構造解析を行ったヘリオロドプシン(TaHeR)の光反応過程を詳細に検討しました。すでに48C12はO中間体の形成と崩壊の速度がTaHeRよりも10倍程度速いことがわかっていましたが、その構造的要因はわかっていませんでした。まず、時間分解赤外分光法を用いてタンパク質骨格構造のプローブとなるamide Iバンドの解析を行いました。しかし、O中間体の形成はマイクロ秒の時間領域で起こるため、従来の時間分解赤外分光法では捉えることができませんでした。そこで、本研究ではマイクロ秒の時間分解能をもつ新規の時間分解赤外分光法である量子カスケードレーザーによるデュアルコム分光法を用いました。その結果、48C12では1664 cm-1のピークが大きく現れました(図2)。このピークは水素結合が緩んだαヘリックスであるαⅡヘリックス由来であり、アミノ酸配列中にセリンやスレオニンなどのアミノ酸が集中することで現れます。
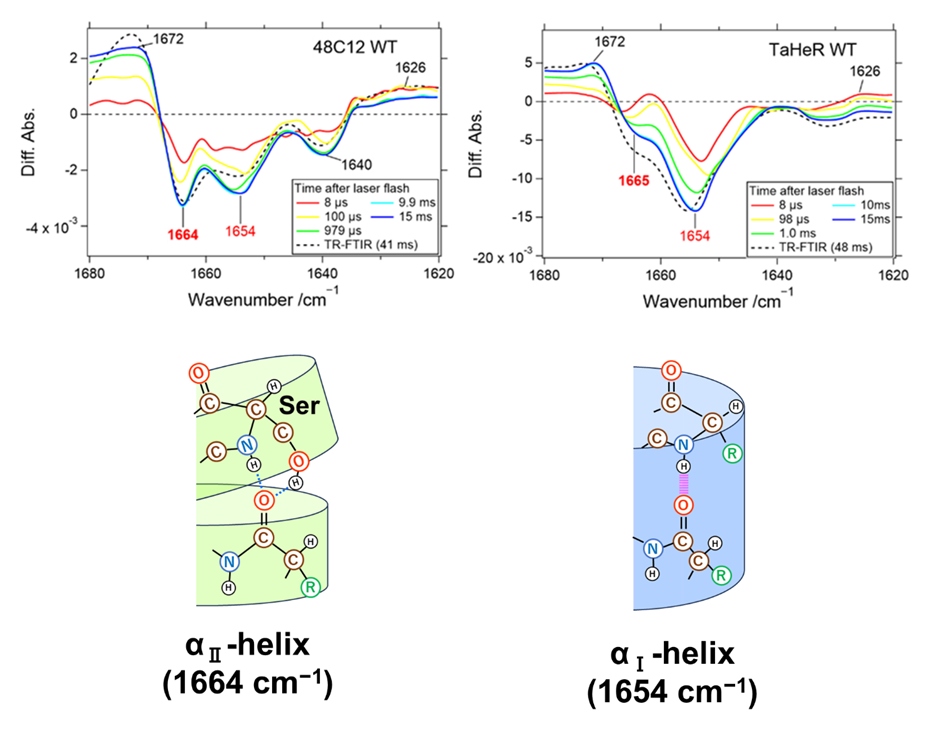
図2 量子カスケードレーザーを用いたデュアルコム分光法によるamide Iバンドの時間分解計測によって明らかにされた2種類のαヘリックスの構造変化
48C12とTaHeRのアミノ酸配列を詳しく調べると、48C12には3番目のヘリックスに3つの連続したセリン残基が存在しているのに対して、TaHeRの該当箇所では真ん中のセリン残基がアラニンに代わっていることが明らかになりました。さらに、48C12の真ん中のセリン残基は4番目のヘリックスのアスパラギン残基と水素結合を行っているのに対して、TaHeRではそれぞれアラニン残基とスレオニン残基であるために水素結合が形成できないことがわかりました。そこで、この水素結合を入れ替えた変異体である48C12の変異体(S112A/N138T)とTaHeRの変異体(A113S/T139N)を作成してO中間体の時間分解測定を行いました(図3)。
その結果、O中間体の形成・崩壊の時定数をほぼ入れ替えることに成功し、この水素結合が48C12のO中間体の形成と崩壊の速度を速めていることがわかりました。この水素結合を形成するアミノ酸残基を一文字表記で示すとS(セリン)とN(アスパラギン)であることからSNapボンドと名付けました。鞄の留め金となる磁石Snap buttonのようにヘリックス3と4を水素結合で留めていることもイメージされます。
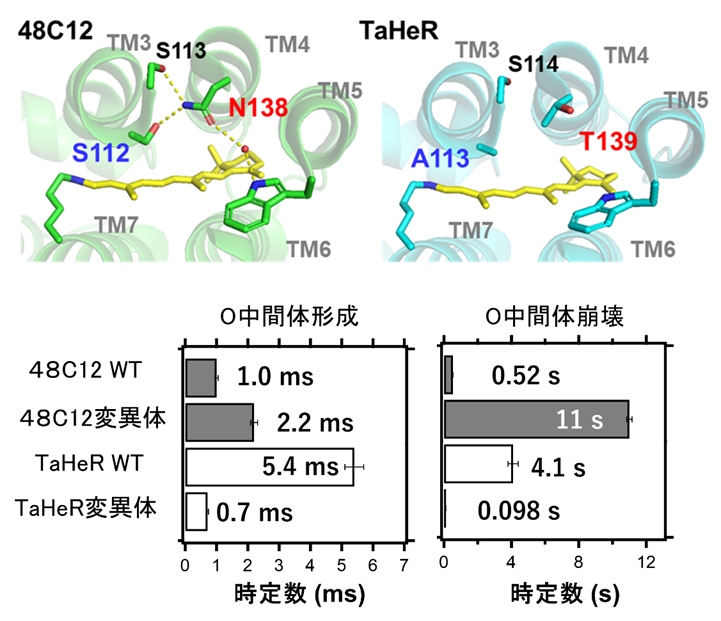
図3 SNapボンドの交換によるO中間体の形成・崩壊速度の調節
さらにSNapボンドがヘリオロドプシンにどの程度保存されているかを確認するために、公的データベース上のヘリオロドプシンを3,612種類収集して配列アライメントを行いました。その結果、SNapボンドは2,579種類(72%)のヘリオロドプシンで保存されており、普遍的に存在することがわかりました。また、過去の文献等で報告されているヘリオロドプシンの光反応サイクルの速度の差はSNapボンドの有無で説明がつき、SNapボンドはヘリオロドプシンの光反応サイクルの速度を決める1つのルールであることを明らかにしました。
社会的な意義・今後の展望
2018年に初めて報告してからヘリオロドプシンの機能の一端が徐々に明らかにされてきました。その中には生体内での代謝系に関与している酵素や薬剤輸送能をもつ膜タンパク質を光制御する報告があり、従来のイオンチャネルやイオン輸送型の微生物ロドプシンによる神経細胞の応答制御とは異なる形での光遺伝学ツールとしての応用が期待されています。今回の発見により、ヘリオロドプシンのSNapボンドの導入・除去でO中間体の持続時間を人為的に変更することで、酵素活性や薬剤輸送活性を調節することが可能になり、生物の光操作において強弱をつけるフレキシブルな応用が期待されます。
本研究は、JSPS科研費 特別推進研究(21H04969)および新学術領域研究「高速分子動画」(19H05784)、文部科学省共同利用・共同研究システム形成事業~学際領域展開ハブ形成プログラム(JPMXP1323015482)、JST-CREST研究(JPMJCR1753)の支援を受けて行われました。
用語解説
(注1)ヘリオロドプシン
我々の眼にある明暗や色を識別するロドプシンを動物ロドプシンもしくはタイプ2ロドプシンとし、細菌などの微生物にあるイオン輸送、イオンチャネル、光センサーなどの機能をもつロドプシンを微生物ロドプシンもしくはタイプ1ロドプシンとして分類されてきました。2018年にイスラエル最大の淡水湖であるガリラヤ湖(英語名Lake Kinneret)に生息する微生物の遺伝子を網羅的に解析することにより、これまでのタイプ1ともタイプ2とも異なる第3のロドプシンとしてヘリオロドプシンが発見されました。
「神取研究室の論文がNature誌に掲載されました―光を信号へと変換するタンパク質の新型、ヘリオロドプシンを発見 生物の新たな光利用戦略が明らかに!―」(2018年6月21日)
(注2)オプトジェネティクス(光遺伝学)
ロドプシンなどの光応答性タンパク質の遺伝子を細胞に導入することで、生命機能を光で制御する方法のことをオプトジェネティクス(光操作)技術といいます。緑藻類から単離されたチャネルロドプシン2を動物の脳にある神経細胞に導入することで、行動や生理応答を制御する研究が脳科学を飛躍的に進展させました。
論文情報
論文名:SNap bond, a crucial hydrogen bond between Ser in helix 3 and Asn in helix 4, regulates the structural dynamics of heliorhodopsin
著者名:Toshiki Nakamura, Manish Singh, Masahiro Sugiura, Soichiro Kato, Ryo Yamamoto, Hideki Kandori, and Yuji Furutani* *責任著者
掲載雑誌名:Journal of Molecular Biology
公表日:2024年6月14日
DOI: 10.1016/j.jmb.2024.168666
URL:https://www.sciencedirect.com/science/article/pii/S0022283624002614
お問い合わせ先
研究に関すること
名古屋工業大学大学院工学研究科工学専攻(生命・応用化学類)
准教授 古谷 祐詞
電話:052-735-5127
E-mail:furutani.yuji[at]nitech.ac.jp
広報に関すること
名古屋工業大学 企画広報課
TEL: 052-735-5647
E-mail: pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
名古屋市における救急搬送の現状と課題 ~時々刻々と変化する救急需要に応じた救急隊の最適配置に向けて~ 汽水・海水環境下で土壌・地下水を浄化できるデハロゲニモナス属細菌の単離に成功 ~塩分濃度4%の環境下で塩素化エチレン類を無害化~

