非古典的チャネルロドプシンGtCCR4の高感度光受容機構を解明
News&Topics
カテゴリ:プレスリリース|2024年9月 4日掲載
東京大学
名古屋工業大学
発表のポイント
◆クリプト藻由来チャネルロドプシンGtCCR2およびGtCCR4の構造解析に成功し、GtCCR4に特有の新規構造を明らかにしました。
◆GtCCR2およびGtCCR4について電気生理実験および時分割分光実験、低温赤外分光実験を行ったところ、GtCCR4がその特有の構造によりチャネルの回復時間を不要とし、高感度光受容を達成していることが示唆されました。
◆GtCCR4の光遺伝学的特性の包括的評価および高活性変異体の創出により、GtCCR4の光遺伝学ツールや遺伝子治療薬へのさらなる応用可能性を見出しました。
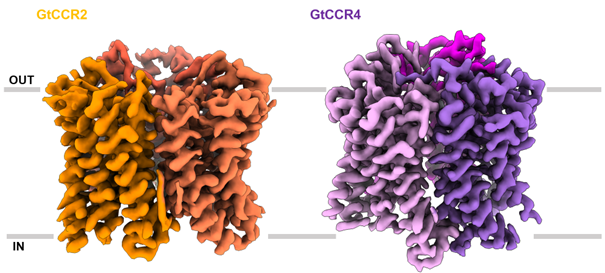
GtCCR2およびGtCCR4のクライオ電子顕微鏡マップ
概要
今回、東京大学大学院理学系研究科の濡木理教授らのグループと名古屋工業大学生命・応用化学類の神取秀樹特別教授らのグループは、共同研究によってチャネルロドプシン(注1)であるGtCCR2及びGtCCR4の立体構造をクライオ電子顕微鏡(Cryo-EM)(注2)を用いた単粒子解析(注3)によって決定しました。
GtCCRは2016年に初めて報告されたクリプト藻(注4)由来のチャネルロドプシンです。このGtCCRは緑藻(注5)由来のチャネルロドプシン-2に代表される古典的チャネルロドプシン(注6)とは進化的に遠く、むしろプロトンポンプであるバクテリオロドプシン(注7)と同じモチーフを有する非古典的チャネルロドプシンです。中でもGtCCR4は、GtCCR1-3やチャネルロドプシン-2と比べ10倍以上高い光感度を有し、新規光遺伝学ツール(注8)や失明患者に対する遺伝子治療薬(注9)として研究が進められています。しかし、どのようにしてGtCCR4が高感度光受容を達成しているのか、その詳細なメカニズムは不明でした。
今回、クライオ電子顕微鏡を用いてGtCCR2及びGtCCR4の構造を決定し、さらに電気生理実験(注10)、分光実験(注11)を行うことでGtCCR4の高感度光受容メカニズムを明らかにしました。GtCCR4はその6番目の膜貫通ヘリックスが大きく折れ曲がっていることにより活性化に伴うタンパク質骨格の構造変化を省略し、チャネルが閉じてから再び光を受容できるようになるまでの回復時間を不要とすることで高感度光受容を達成していることが示唆されました。加えて、GtCCR4の光遺伝学的特性の包括的評価、高活性変異体の創出を行い、GtCCR4の光遺伝学ツールとしてのさらなる可能性を見出しました。この研究成果により、新規高感度光遺伝学ツールや網膜色素変性に対する遺伝子治療薬開発への貢献が期待されます。
発表内容
研究の背景
チャネルロドプシンは微生物ロドプシンの一種であり、光を受容してチャネルを開きさまざまなイオンを透過させます。2005年にチャネルロドプシン-2を用いた神経の発火の制御が報告されて以来、チャネルロドプシンは光遺伝学ツールとして広く研究・利用されてきました。加えてチャネルロドプシンは遺伝性の難病である網膜色素変性に対する遺伝子治療薬としても研究が進められており、網膜色素変性によって視力を失った患者の網膜にチャネルロドプシンを発現させることで視力の一部を回復させた報告もされています。
GtCCRは2016年に初めて報告されたクリプト藻由来のチャネルロドプシンです。このGtCCRは緑藻由来のチャネルロドプシン-2に代表される古典的チャネルロドプシンとは進化的に遠く、むしろプロトンポンプであるバクテリオロドプシンと同じモチーフを有するためバクテリオロドプシン様チャネルロドプシンとも呼ばれます。中でもGtCCR4はGtCCR1-3やチャネルロドプシン-2の10倍以上の光感度を有し、次世代の光遺伝学ツールおよび遺伝子治療薬として研究が進められてきました。しかしGtCCR4がどのようにして高感度光受容を達成しているかは説明ができませんでした。そこで、同じGtCCRファミリータンパク質であるGtCCR2とGtCCR4の構造を決定し、さらに機能解析を行いそれらの結果を比較することでGtCCR4の高感度光受容機構を明らかにしようと試みました。
研究内容と成果
本研究では、クライオ電子顕微鏡を用いた単粒子解析法によってGtCCR2およびGtCCR4の構造をそれぞれ2.7 Åの分解能で決定しました(図1)。GtCCR2およびGtCCR4は、バクテリオロドプシンや他のバクテリオロドプシン様チャネルロドプシンであるChRmineなどと同様にホモ三量体を形成していました。
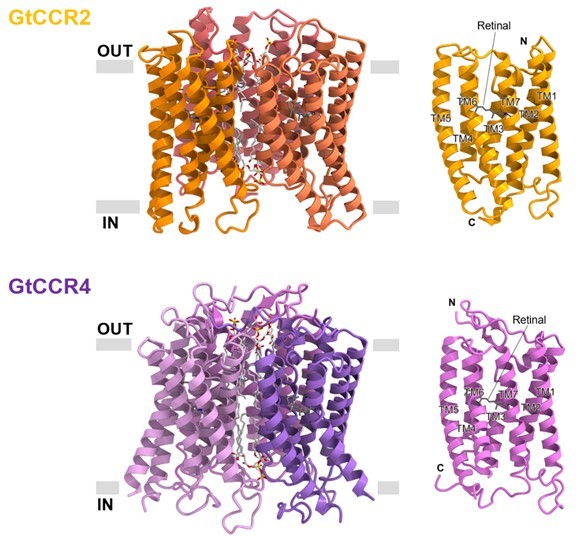
図1:GtCCR2とGtCCR4の三量体(左)および単体(右)構造
驚くべきことに、GtCCR4の6番目の膜貫通ヘリックスはGtCCR2やチャネルロドプシン-2などと比べ大きく折れ曲がった構造を有していました(図2)。これまで微生物ロドプシンが活性化する際にTM6を曲げることは報告されてきましたが、基底状態において微生物ロドプシンのTM6が折れ曲がっている様子ははじめて見られました。
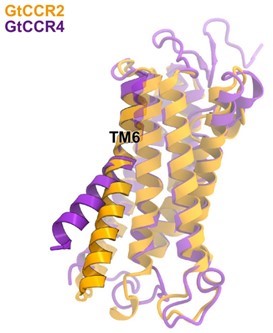
図2:GtCCR2とGtCCR4のTM6の比較
次に、この構造が光反応の時定数に与える影響を調べるため、フラッシュレーザーを用いた電気生理実験および時分割分光実験を行いました。フラッシュレーザーによりGtCCR2及びGtCCR4を励起し、電流の減衰よりチャネル閉時間を、中間体による吸収の減衰および基底状態による吸収の戻りよりチャネル回復時間をそれぞれ決定しました。GtCCR2では、チャネル閉時間が4.08 ms、チャネル回復時間が11.8 msと決定され、チャネルが閉じてから再び光を受容できるようになるまで約7 msかかることが分かりました(図3左)。対照的にGtCCR4では、チャネル閉時間が20.9 ms、チャネル回復時間が19.5 msと決定され、チャネルが閉じるとほぼ同時に基底状態に戻り、再び光を受容できるようになることが明らかになりました(図3右)。
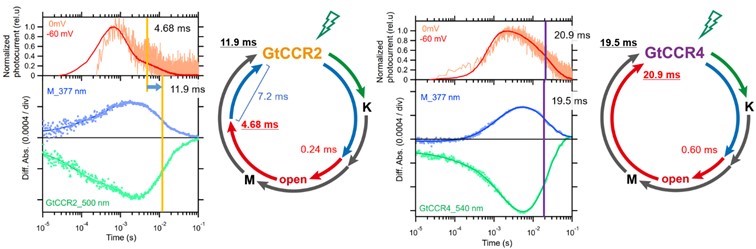
図3:GtCCR2とGtCCR4のフォトサイクルにおける時定数
加えて、低温赤外分光実験によってGtCCR2およびGtCCR4の活性化に伴うペプチド骨格の変化を観測しました。一般にタンパク質の赤外吸収スペクトルにおいては、1650 cm-1付近(アミドⅠバンド)のピークが二次構造の変化を反映します。GtCCRにおいてはK中間体とM中間体の間で構造変化が起こると考えられ、これらのスペクトルを比較すると、GtCCR4はGtCCR2に比べ変化がほとんど見られませんでした(図4)。これより、GtCCR4では活性化に伴う構造変化が小さいことが明らかになりました。

図4:GtCCR2とGtCCR4の低温赤外分光スペクトル
これらの構造解析、電気生理実験および分光実験で得られた結果より、GtCCR4は基底状態において大きく折れ曲がった6番目の膜貫通領域(TM6)を有することで活性化に伴うタンパク質骨格の構造変化を省略し、チャネルが閉じてから再び光を受容できるようになるまでの回復時間を不要とすることで高感度光受容を達成していることが示唆されました(図5)。これまでチャネル閉時間と光感度の間には正の相関があることが示されていましたが、GtCCR4はチャネル閉時間の長さでは説明できない高い光感度を有していました。この結果は、チャネルロドプシンの新規構造によるダイナミクスの制御を示唆するとともに、チャネル回復時間という新たな光感度のファクターを示しました。
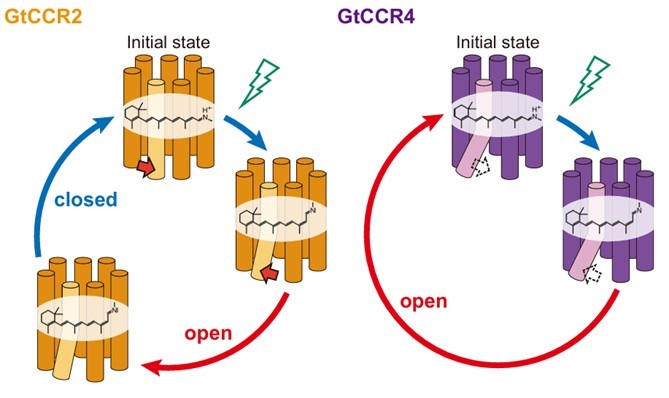
図5:GtCCR2とGtCCR4の光活性化モデル
最後に、本研究グループは詳細な特性が明らかになっているチャネルロドプシンChRmine をコントロールとして用い、GtCCR4の光遺伝学的特性を包括的に評価しました。これらの連続的および断続的な長期刺激による光電流を比較したところ、GtCCR4の不活性化はChRmineに比べ小さく照射終了まで照射開始時の電流をほぼ維持する結果となりました(図6左)。また、ラット大脳皮質由来の初代培養神経細胞を用いて断続的な光刺激による神経発火を計測したところ、ChRmineでは光に同期した発火の成功率が約61%であったのに対し、GtCCR4は約91%と高い値を示しました(図6右)。これらの結果は、GtCCR4の光感受性が高いのみならず確実性の高いツールであることを示しています。加えて、本研究ではアミノ酸配列を元にしたスクリーニングにより野生型と比較し約3倍の光電流を呈するGtCCR4の高活性変異体を見出しており、GtCCR4の光遺伝学ツールおよび遺伝子治療薬としての応用が期待されます。
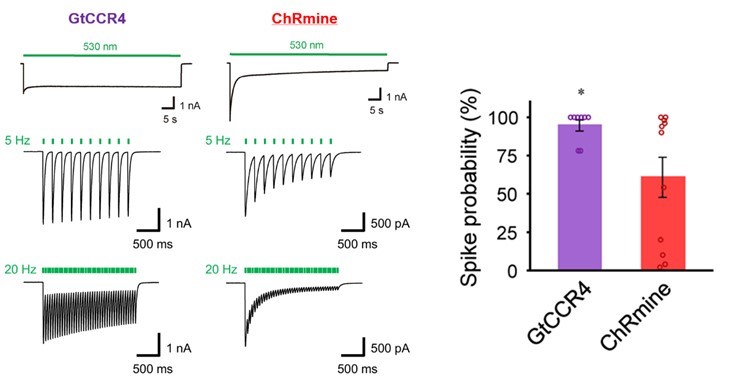
図6: GtCCR4とChRmineの光電流(左)および発火成功率(右)の比較
本研究の成果は、微生物ロドプシンの構造及びダイナミクスの理解に大きな手がかりを提供すると共に、新たな高感度光遺伝学ツールおよび失明患者に対する遺伝子治療薬開発に大きく貢献することが期待されます。
発表者・研究者等情報
東京大学 大学院理学系研究科 生物科学専攻
田中 達基 特任助教
飯田 航 博士課程
佐野 文哉 博士課程
小田 和正 博士課程(研究当時)
志甫谷 渉 助教
濡木 理 教授
名古屋工業大学
大学院工学研究科
山下 陽 修士課程(研究当時)
重村 竣太 修士課程(研究当時)
中村 敏規 修士課程
杉本 哲平 博士課程
生命・応用化学類
細島 頌子 特任助教
片山 耕大 准教授
古谷 祐詞 准教授
角田 聡 特任准教授
神取 秀樹 特別教授
名古屋大学 大学院理学研究科 理学専攻
内橋 貴之 教授
論文情報
雑誌名:Molecular Cell
題 名:The high-light-sensitivity mechanism and optogenetic properties of the bacteriorhodopsin-like channelrhodopsin GtCCR4
著者名:Tatsuki Tanaka, Shoko Hososhima, Yo Yamashita, Teppei Sugimoto, Toshiki Nakamura, Shunta Shigemura, Wataru Iida, Fumiya K. Sano, Kazumasa Oda, Takayuki Uchihashi, Kota Katayama, Yuji Furutani, Satoshi P. Tsunoda, Wataru Shihoya*, Hideki Kandori*, Osamu Nureki*.
(*共同責任著者)
DOI: 10.1016/j.molcel.2024.08.016.
URL: https://doi.org/10.1016/j.molcel.2024.08.016
研究助成
本研究は、日本学術振興会における科学研究費助成事業の基盤S「生体環境でのGPCRの構造ダイナミクス」(研究代表者:濡木 理)や基盤B「クライオ電子顕微鏡法を用いたGPCR創薬研究」(研究代表者:志甫谷 渉)、新学術領域研究「光動作タンパク質の時分割構造解析と合理的改変」、特別推進研究「光遺伝学を支えるロドプシンの作動メカニズムの解明」(研究代表者:神取 秀樹)、文部科学省の学際領域展開ハブ形成プログラム「マルチスケール量子-古典生命インターフェース研究コンソーシアム」、第一三共株式会社TaNeDSプログラムの一環で行われました。また、本研究は、AMED「創薬等ライフサイエンス研究支援基盤事業」および「革新的先端研究開発支援事業インキュベートタイプ」の一環として、放射光施設などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
用語解説
(注1)チャネルロドプシン
七本の膜貫通ヘリックスを持つオプシンタンパク質と発色団であるレチナールから成る微生物ロドプシンの一種。光を受容しチャネルを開くことで、イオンを受動的に輸送する。これまでに陽イオンを透過するものや陰イオンを透過するもの、陽イオンの中でも一価の金属イオンを選択的に透過するものなどさまざまな特性のチャネルロドプシンが見つかっている。
(注2)クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質や核酸をはじめとする生体高分子の像を多数撮影することで立体構造の決定を行う、単粒子解析法に用いられる。
(注3)単粒子解析
多数の均一な粒子を観察、撮影し、画像処理によって粒子の詳細な構造を得る手法。単一の撮影像よりも分解能を向上させることができるほか、さまざまな方向を向いた粒子を撮影することで、3次元立体構造を把握することが可能となる。
(注4)クリプト藻
主にクリプト藻植物門クリプト藻綱に含まれる単細胞藻類の総称。真核生物で多くは2本の鞭毛を有し、光走性を呈する。
(注5)緑藻
藻類全体を指す場合もあるが、ここでは緑藻植物門緑藻綱に含まれる藻類の総称として用いた。真核生物であり、単細胞から群体、多細胞のものまで多様な種が含まれる。チャネルロドプシン-2を有するコナミドリムシは単細胞生物であり、鞭毛を有する。
(注6)古典的チャネルロドプシン
ここでは最初に同定されたチャネルロドプシンであるコナミドリムシのチャネルロドプシン-1およびチャネルロドプシン-2を含む、緑藻由来チャネルロドプシン群を指す。主にホモ二量体を形成する。
(注7)バクテリオロドプシン
高度好塩菌が持つロドプシンファミリータンパク質であり、光エネルギーによって水素イオンを外向き(細胞外側)に能動輸送するプロトンポンプ。最初に発見され、また初めて構造が決定された微生物ロドプシンであり、モデルタンパク質として用いられる。
(注8)光遺伝学
光応答性のタンパク質を遺伝学的に個体に導入することで、生命活動を光によってコントロールする手法。特にチャネルロドプシンを神経細胞に導入し、光によって陽イオンを流入させ神経を発火させる手法は神経細胞の機能解析等に広く用いられている。ほかにも、内向き陰イオンポンプロドプシンを神経細胞に発現させ神経の発火を抑制する手法などが知られている。
(注9)遺伝子治療
ウイルスベクターなどを用いて特定の遺伝子を患者の細胞に導入することで病状の改善を図る治療。チャネルロドプシンを用いた失明治療の場合、視神経にチャネルロドプシンを導入することで光に応答して視神経を発火させ、健全な状態のシグナル伝達を模倣する。
(注10)電気生理実験
電極を細胞表面等に固定し、電流を測定することによってイオンチャネルやイオンポンプによる細胞内外のイオンの流れを観測する手法。本研究では、一般的な定常光照射による測定だけでなく、レーザー光照射による測定も行われた。
(注11)分光実験
物質が吸収・放出する光のスペクトルを測定することでその構造を調べる手法。本研究では、可視光領域の時間分解吸収分光や低温吸収分光、赤外光領域の低温吸収分光が用いられた。
問い合わせ先
研究に関すること
東京大学大学院理学系研究科 生物科学専攻
教授 濡木 理(ぬれき おさむ)
TEL:03-5841-4394
E-mail:nureki[at]bs.s.u-tokyo.ac.jp
名古屋工業大学 生命・応用化学類
特別教授 神取 秀樹(かんどり ひでき)
TEL:052-735-5207
E-mail:kandori[at]nitech.ac.jp
報道に関すること
東京大学大学院理学系研究科・理学部 広報室
TEL:03-5841-8856
E-mail:media.s[at]gs.mail.u-tokyo.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
E-mail:pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
「知の拠点あいち重点研究プロジェクトⅣ期」 手指デバイスを用いた精神的フレイルの予防・回復支援に 役立つ脳トレシステムを開発しました 電子材料技術の鍵となる新奇ペロブスカイト強誘電体を発見 ~分子レベルの積木細工で、未踏物質の合成に成功~

