アセチルコリン受容体活性化の鍵を発見 ~次世代薬剤設計の可能性を拡げるGPCRメカニズム解明の新たな一歩~
News&Topics
カテゴリ:プレスリリース|2025年3月17日掲載
名古屋工業大学/関西医科大学/東北大学/京都大学
発表のポイント
〇 心拍数調節に関わるムスカリン性アセチルコリン受容体(M2R)(注1)における404番目のアスパラギン残基(Asn404)の赤外信号(注2)を特定
〇 M2R活性化における膜貫通ヘリックス6(TM6)(注3)の構造変化を引き起こす水素結合ネットワークを実証
〇 Gタンパク質共役型受容体 (GPCR)(注4)全体における活性化メカニズムの解明に向けた新たな視点を提供し、神経変性疾患や認知症、心臓病などの創薬研究への寄与に期待
概要
名古屋工業大学 大学院工学研究科工学専攻生命・応用化学系プログラムの杉浦勇也氏(研究当時)、生命・応用化学類の片山耕大准教授、神取秀樹特別教授、柴田哲男教授、住井裕司准教授、関西医科大学医学部医化学講座の清水(小林)拓也教授、寿野良二准教授、東北大学大学院薬学研究科の井上飛鳥教授、生田達也助教、京都大学大学院医学研究科の岩田想教授らのグループは、振動分光法(注5)を用いて、心拍数の調節に関与するムスカリン性アセチルコリン受容体(M2R)が内因性アゴニスト(注6)であるアセチルコリンによって活性化される仕組みを解明しました。
本研究では、M2Rのリガンド(注7)結合部位を構成するアミノ酸の1つであるアスパラギン残基(Asn404)とアセチルコリンの間の精密な相互作用が、M2Rの活性化に極めて重要であることを突き止めました。また、N404Q変異体が部分的に活性型様の構造変化を示すことを明らかにし、この相互作用を支える水分子が、柔軟かつ精密な水素結合ネットワークを形成し、膜貫通ヘリックス6(TM6)の構造変化を引き起こすことを発見しました。
さらに、アセチルコリン分子の特定部位を化学修飾してこの水素結合ネットワークを破壊すると、M2Rを正常に活性化できないことを確認しました。これらの結果から、Asn404はアセチルコリンの結合を感知し、M2Rの活性化を誘導する鍵となる重要な残基であることが示されました。
この研究成果は、Gタンパク質共役型受容体(GPCR)の活性化メカニズムの全貌解明に向けた新たな道を拓くだけでなく、次世代の薬剤設計における革新的な指針となる可能性があります。
研究の詳細は、2025年3月14日付で「Journal of the American Chemical Society」誌に掲載されました。
研究の背景
タンパク質などの生体分子は、その構造を動的に変化させることで機能を発揮します。恒常性や感覚器など多様なシグナル伝達に関わる膜タンパク質GPCRは、細胞外からリガンドを受容すると、水素結合ネットワークの組み換えなどの動的変化を介して、細胞内での大きな構造変化を誘起します。そして、リガンドを受容したGPCRがGタンパク質などのシグナル伝達タンパク質を介してシグナル伝達経路を活性化させることで、多様な細胞応答が生まれます。
最近、このシグナル伝達経路の活性化の程度(薬効度)は、リガンド結合に伴うGPCRの動的構造変化の違いに由来することが、NMRなどの分光法によって見出されるようになりました。GPCRとリガンドあるいはシグナル伝達タンパク質との複合体の静的な立体構造情報に加え、GPCR作動過程での動的な構造変化情報を獲得することが重要視されています。
特に、生体内では、GPCRは機能や発現部位が異なる複数のサブタイプが存在し、それらのリガンド結合部は極めて似通っています。それにもかかわらず、生体内で多様な細胞応答が恒常的に正しく発現するのは、各受容体サブタイプが同一の内在性リガンドあるいは類似化合物を正確かつ、自由度を利かせてリガンドを認識し、それに続くシグナリングを行っているからだと考えられています。従って、GPCRの運動性を取り入れた動的構造変化情報を有効活用できれば、アミノ酸の一次配列や立体構造のスナップショットからだけでは導き出せない、サブタイプ間でのわずかな違いを利用した薬剤開発が可能になります。
本研究グループは、これまでに赤外分光法を最適化して、GPCRにリガンドやシグナル伝達タンパク質が結合した際の動的な構造変化情報を、分子振動の変化としてスペクトル測定する研究を展開してきました。具体的には溶液循環系を赤外分光装置へ取り付け、測定基板上に吸着させたGPCRに薬効度の異なるリガンドを流すことで、リガンド結合前後の赤外差スペクトルを計測することに取り組んできました。その結果、GPCRの中で神経変性疾患や認知症、心臓病などの創薬標的として注目される、ムスカリン受容体の一つ、M2Rに対し、作動薬や阻害薬など、薬効度の違いに対応したM2Rの構造変化を赤外差スペクトルとして取得することに成功しました(図1)。また、本手法は天然環境に近い状態で測定していることも特筆すべき点です。さらに、リガンド濃度依存性や受容体への結合・解離を1秒未満の時間分解能で追跡し、動的変化の定量解析を可能にしました。
研究の内容・成果
今回、本研究グループは、スペクトル解析に基づいて、M2Rがリガンドを受容してからシグナル伝達に至る一連の動的構造変化を原子分解能で解明することを目的としました。そのために、アミノ酸変異体およびリガンドの同位体標識・誘導体を用いた測定を実施し、さらに計算科学を組み合わせることで、構造変化に対応する赤外信号の帰属を試みました。
具体的には、天然リガンドであるアセチルコリンの結合部位を構成するアミノ酸の一つ、404番目のアスパラギン残基(Asn404)をグルタミン残基(Gln)に置換したN404Q変異体を用いた測定を行い、アセチルコリン結合時におけるAsn404の水素結合変化に対応する赤外信号の帰属に成功しました (図2a)。さらに、アセチルコリンの13C同位体標識試料を用いた測定を行い、M2Rの野生型およびN404Q変異体に結合したアセチルコリンの赤外信号を特定しました(図2b)。
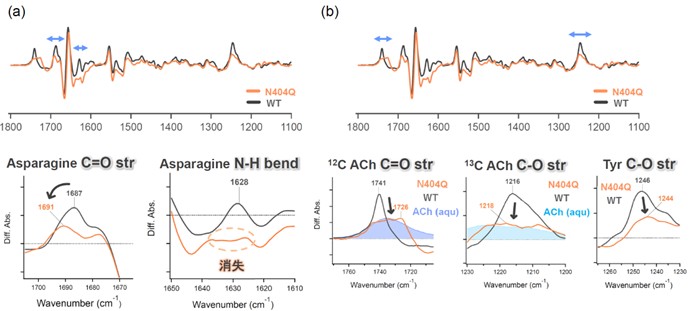
(a)M2Rの野生型(WT)およびN404Q変異体に対するアセチルコリン結合誘起赤外差スペクトル。正側の1687 cm-1バンドをAsn404のC=O伸縮振動由来と帰属(b)正側の1741および1216 cm-1バンドをアセチルコリンのC=O伸縮振動およびC-O-伸縮振動と帰属
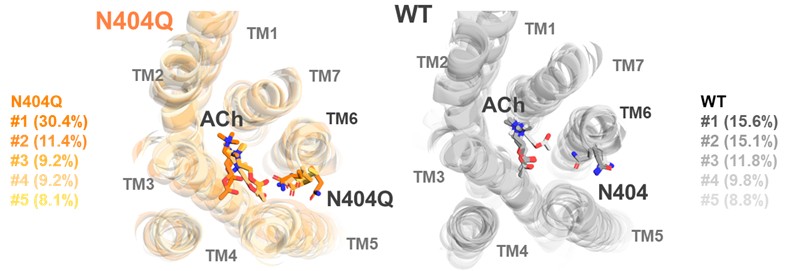
また、重水(2H2O)中での測定に加え(図3a, b)、M2Rに対するアセチルコリン結合の分子動力学(MD)シミュレーション解析を実施しました(図4)。その結果、アセチルコリンとAsn404の間に水分子が介在し、適度な柔軟性を持つ相互作用(精密性と自由度のバランス)を形成することが明らかとなりました。さらに、この絶妙な水素結合がM2Rの活性化に重要であることを示しました(図3c)。
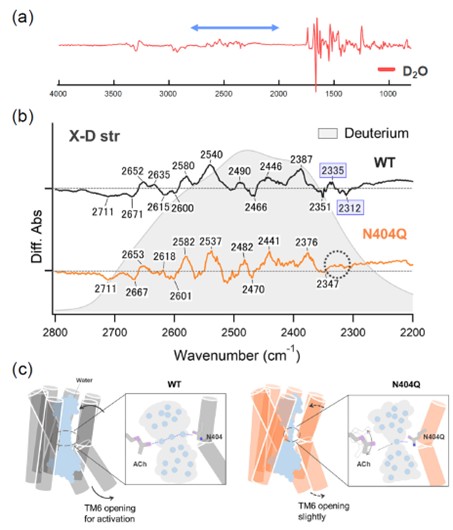
(a)水の同位体標識(2H2O)環境下で測定したM2Rのアセチルコリン結合スペクトル(中赤外振動数領域)(b) 2H2O環境下で測定したM2RのWTおよびN404Q変異体におけるアセチルコリン結合スペクトルの比較。N404Q変異体では、水の赤外信号(2335 (+)/2312 (-) cm-1)が消失(c) M2RのWTおよびN404Q変異体におけるアセチルコリン結合機構の違いを示す
本研究により、水分子が形成する柔軟かつ精密な水素結合ネットワークが、受容体の構造変化と活性化を駆動する仕組みを明らかにしました。さらに、Asn404を介する微視的な相互作用の変化を応用することで、M2Rの活性を自在に制御可能なアセチルコリン誘導体の設計指針を提示しました。本研究の成果は、GPCRの活性化メカニズム解明に新たな知見をもたらすとともに、次世代の革新的なリガンド設計の基盤を築く重要な成果です。
社会的な意義・今後の展望
タンパク質の構造解析は生命現象を可視化することにつながりますが、現在その構造決定手法の著しい技術革新によって、静止画像を捉えるフェーズから、実際にタンパク質が動いている様子、動的画像を捉える段階へ突入しています。特にX線自由電子レーザーを利用した時間分解結晶構造解析や、クライオ電子顕微鏡測定から得られるタンパク質粒子の構造不均一画像から構造ダイナミクスを再構築する構造解析によって、GPCRや膜タンパク質の作動過程の中間体構造が原子レベルで明らかになりつつあります。
それにもかかわらず、タンパク質内部で中間体間の遷移あるいは活性化をどのような化学的相互作用変化が誘起しているのかを実験的に捉えた例は依然として限られています。こうした状況下で本研究の特筆すべき点は、水素結合などの化学変化に敏感な赤外分光法をGPCRに適用し、リガンド結合に際して起こる受容体や、リガンド自身の動的構造変化の検出を達成したことです。
そして、赤外分光法を用いたスペクトルデータを基にして、化学的相互作用の変化がタンパク質内部のどこで起きているかを解明した本研究成果は、GPCRの作動機序に関して未だ明らかになっていない、GPCRサブタイプ選択性やシグナル選択性、さらに薬効度の制御機構の理解を大きく前進させる突破口となることが期待されます。この知見は、新規創薬の基盤を形成し、医療分野における革新的な治療法開発への道を切り拓くことが期待されます。
本研究成果は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ「量子技術を適用した生命科学基盤の創出」(JPMJPR19G4)(研究代表者:片山耕大)、日本学術振興会における科学研究費助成事業の基盤研究(B)(研究代表者:片山耕大)(課題番号:23K21097)、特別推進研究(研究代表者:神取秀樹)(課題番号:21H04969)、基盤研究(B)(研究代表者:寿野良二)(課題番号:19H03428, 2402231)、学術変革領域研究(B)(研究代表者:寿野良二)(課題番号:21H05112)、学術変革領域研究(B)(研究代表者:井上飛鳥)(課題番号:21H05111, 21H05113)、基盤研究(A)(研究代表者:井上飛鳥)(課題番号:21H04791)、挑戦的研究 (開拓) (研究代表者:井上飛鳥)(課題番号:24K21281)、科学技術振興機構(JST)創発的研究支援事業 (FOREST)(研究代表者:井上飛鳥)(課題番号:JPMJFR215T)、内閣府 (CAO) ムーンショット型研究開発制度 (研究代表者:井上飛鳥)(課題番号:JPMJMS2023)、日本医療研究開発機構(AMED) (研究代表者:井上飛鳥)(課題番号:JP22ama121038, JP22zf0127007)の一環で行われました。
用語解説
(注1)ムスカリン性アセチルコリン受容体(M2R)
Gタンパク質共役受容体の一つで、パーキンソン病やアルツハイマー病に関わる神経伝達物質、アセチルコリンを天然リガンドとして受容する膜タンパク質。5種類のサブタイプ(M1RからM5R)が存在しており、今回研究対象としたM2Rは、主に心臓に分布し、心臓機能を抑制的に調節している。
(注2)赤外信号
分子が赤外光を吸収または透過する際に観測されるスペクトル情報を指す。具体的には、分子内の特定の化学結合が赤外光の特定の波数(振動数)のエネルギーを吸収することで生じるピーク(吸収バンド)として表れる。
(注3)膜貫通ヘリックス6(TM6)
膜タンパク質(特にGタンパク質共役受容体)において、細胞膜を貫通するαヘリックス構造のうちの6番目のヘリックスを指す。
(注4) Gタンパク質共役型受容体(GPCR)
細胞膜を7回貫通する膜タンパク質で、細胞外のシグナル(ホルモン、神経伝達物質、光、匂いなど)を細胞内に伝達する受容体。生体内のシグナル伝達において中心的な役割を担い、多くの医薬品の標的となっている。
(注5)振動分光法
分子の振動 (結合の伸縮や変角運動など) に関連するエネルギーを測定することで、物質の構造や化学環境を分析する手法。分子が特定の振動モードを持つと、それに対応する特定の波長の光を吸収する。
(注6)内因性アゴニスト
生体内の受容体分子に働いて神経伝達物質やホルモンなどと同様の機能を示す薬。生体内で自然に生成され、特定の受容体を活性化する物質。
(注7)リガンド
特定の受容体やタンパク質に結合し、生体内でのシグナル伝達や生化学的反応を引き起こす分子のこと。
論文情報
論文名:Discovering key activation hotspots in the M2 muscarinic receptor
著者名:Yuya Sugiura, Tatsuya Ikuta, Yuji Sumii, Hirokazu Tsujimoto, Kohei Suzuki, Ryoji Suno, Putri Nur Arina Binti Mohd Ariff, So Iwata, Norio Shibata, Asuka Inoue, Takuya Kobayashi, Hideki Kandori, Kota Katayama
掲載雑誌名:Journal of the American Chemical Society
公表日:2025年3月14日
DOI: 10.1021/jacs.4c14385
URL: https://pubs.acs.org/doi/10.1021/jacs.4c14385
お問い合わせ先
研究に関すること
名古屋工業大学 生命・応用化学類
准教授 片山耕大
Tel: 052-735-5218
E-mail: katayama.kota[at]nitech.ac.jp
名古屋工業大学 生命・応用化学類
教授 柴田 哲男
TEL: 052-735-7543
E-mail: shibata.norio[at]nitech.ac.jp
関西医科大学医学部医化学講座
教授 清水(小林)拓也
TEL: 072-804-2340
E-mail: kobayatk[at]hirakata.kmu.ac.jp
京都大学大学院薬学研究科 生体機能解析学分野
東北大学大学院薬学研究科 分子細胞生化学分野
教授 井上 飛鳥
TEL: 022-795-6861
E-mail: iaska[at]tohoku.ac.jp
京都大学大学院医学研究科 分子生体統御学講座 分子細胞情報学分野
教授 岩田 想
TEL: 075-753-4372
Email: s.iwata[at]mfour.med.kyoto-u.ac.jp
報道に関すること
名古屋工業大学 企画広報課
Tel: 052-735-5647
E-mail: pr[at]adm.nitech.ac.jp
関西医科大学 広報戦略室
TEL: 072-804-2128
E-mail: kmuinfo[at]@hirakata.kmu.ac.jp
東北大学大学院薬学研究科 総務係
TEL: 022-795-6801
E-mail: ph-som[at]grp.tohoku.ac.jp
京都大学 渉外・産学官連携部広報課国際広報室
TEL: 075-753-5729
E-mail:comms[at]mail2.adm.kyoto-u.ac.jp
*[at]を@に置換してください。
メタサーフェス内蔵インテリアパネル「メタッパネ」を発表 ~壁に掛けるだけで、特定方向へWI-FI電波強度がUP!~ 電通大を代表とする提案が東京都の大学研究者による事業提案に採択 ~コミュニケーション・バリアフリー事業~

