藍色光を選択的に吸収するチャネルロドプシンKnChRの構造と機能を解明 ―多波長型光遺伝学ツールへの応用に道―
News&Topics
カテゴリ:プレスリリース|2025年6月19日掲載
東京大学/名古屋工業大学
発表のポイント
〇 車軸藻に由来するチャネルロドプシン「KnChR」が、これまでにない短い波長(藍色光、450 nm)で働く仕組みを解き明かしました。
〇 小型で解析が困難とされていた2量体チャネルロドプシンKnChRの構造解析に成功しました。
〇 さらに短い波長(KnChortRQ:420 nm)に応答できる新しい変異体を作り、多色光による複数種細胞の光刺激計測への応用可能性を広げました。
概要
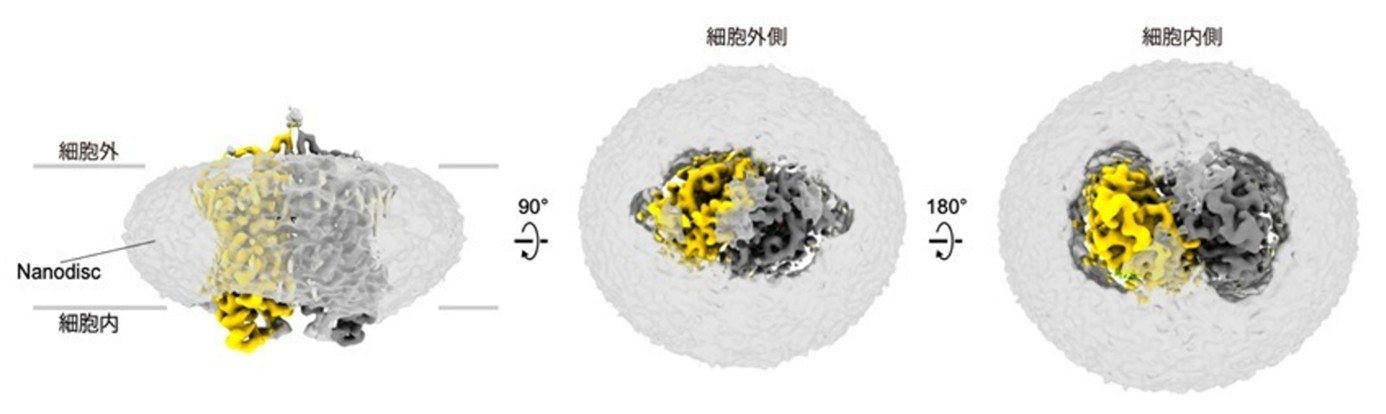
東京大学大学院理学系研究科の濡木理教授と、名古屋工業大学 生命・応用化学類の神取秀樹特別教授らの研究グループは、2量体チャネルロドプシン(ChR)(注1) KnChRの立体構造を、クライオ電子顕微鏡(cryo-EM)(注2)を用いた単粒子解析(注3)で決定しました。
KnChRは2021年に神取特別教授らのグループにより初めて報告された車軸藻(注4) 由来のChRです。これまで知られてきたChRの多くは青緑光(470 nm付近)や黄緑色(540 nm)を吸収して機能します。一方、KnChRは450 nm(藍色光)という短波長で機能しますが、そのメカニズムは不明でした。今回、cryo-EMを用いてKnChRの構造を決定し、さらに電気生理実験(注5)、分光実験(注6)を行うことでKnChRが藍色光を受容する仕組みを明らかにしました。さらに、構造をもとに、より短波長の光に反応できる変異体の作成にも成功し、KnChRのマルチオプトジェネティックス(注7)ツールとしてのさらなる応用可能性を見出しました。
これにより、今後は藍色光を用いた神経ネットワークの光遺伝学的研究(注8)が可能になります。本成果は、うつ病などの精神疾患や心疾患、筋ジストロフィーなどの筋疾患のメカニズム解明と新たな治療法の開発にもつながることが期待されます。
発表内容
研究の背景
チャネルロドプシンは、微生物由来のロドプシンの一種で、結合しているレチナールが光を受容して構造変化を起こすことで、さまざまなイオンを透過するチャネルとして機能します。2005年に、チャネルロドプシン-2(ChR2, CrChR2)が神経の発火を制御できることが報告されて以来、ChRは光遺伝学のツールとして広く研究されています。近年では、異なる波長の光を用いて複数のニューロンを制御する「多色光遺伝学」が注目されていますが、短波長光を感受するChRに関する研究は、依然として限られています。
KnChRは藍色光を吸収する希少なChRですが、その吸収機構は未解明でした。また、KnChRは、古典的なChR群(注9)の中でもチャネルの開口時間に影響する長いC末端領域を持っていますが、その仕組みについても不明でした。本研究では、KnChRの全長構造を解明し、これらの疑問に答えようと試みました。
研究の内容と成果
本研究では、cryo-EMを用いた単粒子解析によって、KnChRのアミノ酸残基27-291番に相当する領域の立体構造を2.7 Åの分解能で決定しました(図1)。KnChRは分子サイズが小さいため、単粒子解析による高分解能構造の決定が困難とされています。今回、人工脂質膜ナノディスク(注10)にKnChRを再構成することで、膜環境に近い安定状態を保ちつつ、ナノディスクを含むより大きな粒子として解析を実施した結果、高分解能での構造決定に成功しました。
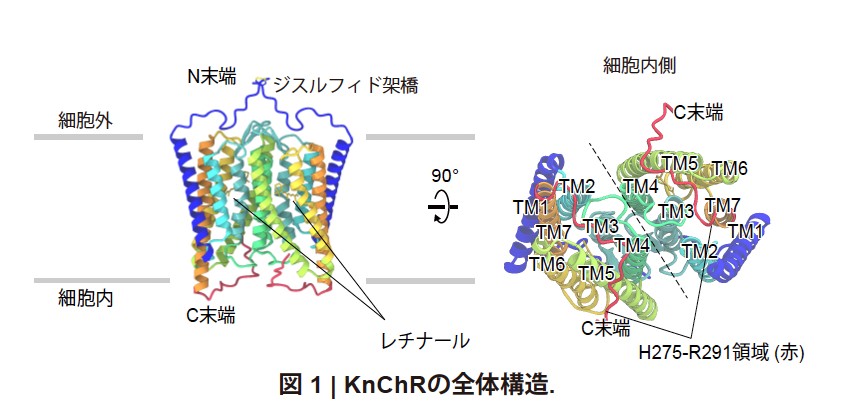
得られた構造情報から、KnChRはCrChR2と同様に2量体を形成することが明らかになりました。KnChRのC末端領域については、H275-R291の領域が明確な構造を形成していることが確認されました。H275-R291領域は、膜貫通領域と相互作用することで、KnChRチャネルの開閉制御に関与している可能性が示唆されました。
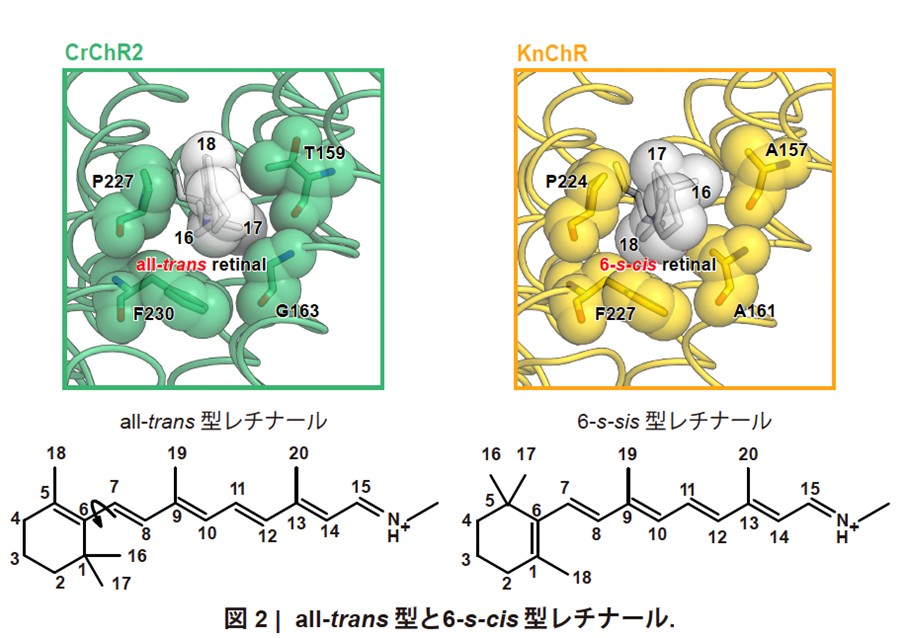
ChRは、結合しているレチナールが光を受容して構造変化を起こすことで、チャネルとして機能します。通常、チャネル閉状態ではレチナールはall-trans型構造をとりますが、KnChRでは例外的に6-s-cis(注11)型構造を有することが明らかとなりました(図2)。all-trans型レチナールでは、6番目および7番目の炭素原子(C6-C7)により平面構造が固定されます(図2)。一方、6-s-cis型レチナールではこの部分にねじれが生じ、ポリエン鎖の平面からβ-イオノン環が約140度回転します(図2)。この構造変化により生じるπ共役系の収縮とそれに伴う励起エネルギーの増大が、吸収波長の短波長シフトに寄与することが示唆されました。
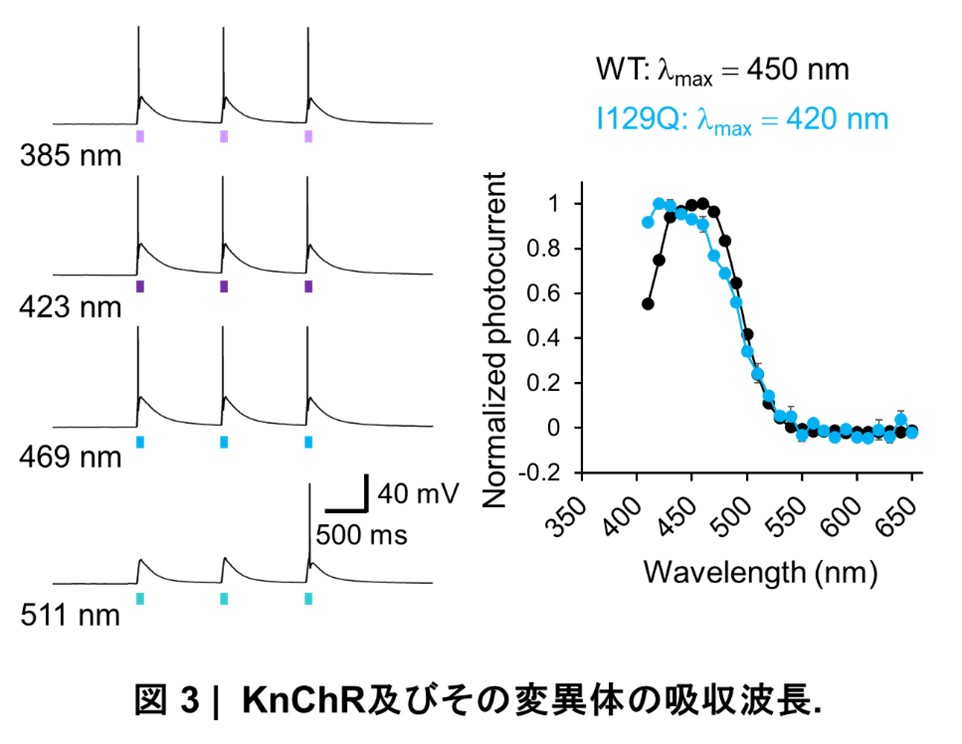
さらに、KnChRをラット大脳皮質由来の初代培養細胞に発現させて神経の発火頻度を評価した結果、藍色光(423 nm) に加えて紫外光(385 nm)も吸収し、神経の発火を引き起こせることがわかりました(図3)。そこで本研究では、より短波長の光を用いた多色光遺伝学の開発を目的として、ChRの吸収波長に関与するレチナール周辺残基とレチナールとの相互作用に注目しました。
プロテオロドプシン群では、105位の残基がロイシンまたはグルタミンの違いにより、吸収波長が緑色光から青色光に変化することが知られています。本研究で明らかになったKnChRの構造から、KnChRの相同残基I129が、レチナールのシッフ塩基(注12)近傍に位置し、かさ高い疎水性残基に囲まれていることを明らかにしました。KnChRのI129をグルタミンに置換したI129Q変異体を作製し、吸収波長の極大をさらに短波長側(420 nm)へとシフトさせることに成功しました(KnChortRQ)(図3)。
本研究の成果は、微生物ロドプシンの構造や吸収波長制御機構の理解を深め、さらに新たな光遺伝学ツールの開発に貢献することが期待されます。
発表者・研究者等情報
東京大学大学院理学系研究科 生物科学専攻
王 雨竹 博士課程(日本学術振興会特別研究員-DC2)
赤坂 浩明 博士課程(日本学術振興会特別研究員-DC1)
佐野 文哉 特任助教
田中 達基 特任助教
濡木 理 教授
慶應義塾大学医学部 坂口光洋記念講座(シグナル探求学)
志甫谷 渉 准教授(研究当時:東京大学大学院理学系研究科)
名古屋工業大学
大学院工学研究科
夏目 航希 修士課程(研究当時)
田代 凜太郎 修士課程(研究当時)
生命・応用化学類
細島 頌子 特任准教授
角田 聡 特任准教授
神取 秀樹 特別教授
論文情報
雑誌名:Nature Communications
題 名:Cryo-EM structure of a blue-shifted channelrhodopsin from Klebsormidium nitens.
著者名:Yuzhu Z. Wang, Koki Natsume, Tatsuki Tanaka, Shoko Hososhima, Rintaro Tashiro, Fumiya K. Sano, Hiroaki Akasaka, Satoshi P. Tsunoda, Wataru Shihoya*, Hideki Kandori*, Osamu Nureki*.
(*共同責任著者)
DOI:10.1038/s41467-025-59299-9
URL:https://www.nature.com/articles/ s41467-025-59299-9
研究助成
本研究は、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)「高難度膜タンパク質等の調製と構造解析可能なグリッド調製の支援」(研究代表者:濡木理)や日本学術振興会における科学研究費助成事業の特別推進研究「光遺伝学を支えるロドプシンの作動メカニズムの解明」(研究代表者:神取秀樹)、文部科学省の学際領域展開ハブ形成プログラム「マルチスケール量子-古典生命インターフェース研究コンソーシアム」の支援により行われました。
用語解説
(注1)チャネルロドプシン (ChR)
微生物ロドプシンの一種で、7本の膜を貫通するヘリックス構造を持つオプシンタンパク質と、発色団レチナールから構成されている。光を受容してチャネルを開き、イオンを受動的に通過させる。
(注2)クライオ電子顕微鏡
液体窒素(-196℃)冷却下で急速凍結した試料に電子線を照射し、分子構造を可視化するための装置。タンパク質や核酸等の生体高分子の多数の投影像を取得し、画像解析によって三次元構造を再構築する単粒子解析法によく用いられる。
(注3)単粒子解析
凍結試料中に存在する多数の同一分子の異なる方向からの電子顕微鏡像を収集し、それらの像の向きや配置を計算的に整列・平均化することで、分子の三次元構造を再構築する手法。結晶化を必要とせず、従来のX線結晶構造解析法より生理的条件に近い状態で高分解能構造情報の取得を可能とする解析技術。
(注4)車軸藻
淡水や湿潤な陸上環境に生息する糸状性緑藻の一種。原始的な陸上植物と系統的に近縁とされ、植物の陸上進出過程や光受容機構の進化を探る上で重要なモデル生物。
(注5)電気生理実験
細胞や組織の電気的活動を測定する技術。電極を細胞表面に接触させ、チャネルを通過する電流を測定することで、チャネルを通過するイオンの量を解析する手法。
(注6)分光実験
物質が吸収または放出する光のスペクトルを測定し、その構造や特性を解析する手法。
(注7)オプトジェネティックス
特定の細胞や組織を光でコントロールする技術。光に応答するタンパク質を細胞内に導入し、光を使ってその細胞の活動を精密に制御する手法。特に、神経細胞にチャネルロドプシンを組み込み、特定の波長の光を受容して陽イオンを流入させ、神経の発火を人工的に制御する方法が近年広く利用されている。
(注8)神経ネットワークの光遺伝学的研究
オプトジェネティックスの一種で、同時に複数波長の光を利用し、異なる神経活動の制御を行う技術。この技術は、神経回路の解析や病気のメカニズム解明、さらには治療法の開発にも広く応用できると大きく期待されている。
(注9)古典的なチャネルロドプシン(ChR)
ここでは、主にホモ二量体を形成する緑藻由来のチャネルロドプシン群を指し、最初に同定されたコナミドリムシのチャネルロドプシン-1および-2がその代表例である。類似した構造を持ち、遺伝子の保存性も比較的に高い。
(注10)ナノディスク
膜タンパク質を生理的な膜環境に近い状態で安定化させるための人工的な脂質二重膜構造体。
(注11)all-trans型レチナールと6-s-cis型レチナール
「all-trans」は、レチナール内の全ての二重結合が反対側(trans)にある構造を意味し、
「6-s-cis」は、6位と7位の炭素間の単結合を軸とした回転によって同じ側(cis)に折れた構造を意味する。本研究では、レチナールがall-trans型か6-s-cis型かによって周囲残基との結合様式が変化し、ロドプシンの吸収波長に影響を与えることが明らかになった。
(注12)シッフ塩基
ここでは、レチナール分子のアルデヒド基と、オプシンタンパク質の7番目の膜貫通ヘリックスに位置するリシン残基のアミノ基との間に形成される共有結合である。シッフ塩基のプロトン化状態は、光受容によるレチナールの異性化反応に大きく関与する。
お問い合わせ先
研究に関すること
東京大学大学院理学系研究科 生物科学専攻
教授 濡木 理(ぬれき おさむ)
TEL:03-5841-4394
E-mail:nureki[at]bs.s.u-tokyo.ac.jp
名古屋工業大学 生命・応用化学類
特別教授 神取 秀樹(かんどり ひでき)
TEL:052-735-5207
E-mail:kandori[at]nitech.ac.jp
報道に関すること
東京大学大学院理学系研究科・理学部 広報室
TEL:03-5841-8856
E-mail:media.s[at]gs.mail.u-tokyo.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
E-mail:pr[at]adm.nitech.ac.jp
*それぞれ[at]を@に置換してください。
フルオロプラスチックの室温分解と再利用に成功 ―高い安全性と持続可能性を両立したフッ素資源循環に貢献― 伝統工芸のデジタル技能伝承に向けた共創プロジェクトを JAPAN CRAFT EXPO 日本工芸産地博覧会 in 大阪・関西万博2025に出展します

