細胞の収縮力を光で評価する方法を新たに開発 ‐平滑筋細胞のタイプを容易に判定する技術‐
News&Topics
カテゴリ:プレスリリース|2019年3月11日掲載
発表のポイント
・細胞が発生する収縮力を光で評価する新手法を開発
・血管平滑筋細胞の病変部で見られるタイプと正常部で見られるタイプを判別
・創薬開発時の技術へ応用されることを期待
概要
今回,名古屋工業大学 電気・機械工学専攻の杉田修啓准教授,松本健郎教授(現名古屋大学),中村匡徳教授,同専攻大学院生の保崎雅俊,産業戦略工学専攻の大学院生水谷衣里(当時)は,細胞が発生する収縮力を光で評価する新たな方法を開発しました.
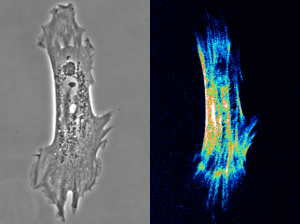 図1. 血管平滑筋細胞の明視野像(左)とリタデーション像(右)
図1. 血管平滑筋細胞の明視野像(左)とリタデーション像(右)
細胞内部には筋肉のような線維構造があり,これを収縮させて移動させたり,周囲の物質を引っ張ったりしています.特に血管内の平滑筋細胞は,周方向に長く配置し,自らを収縮させて血管径を調節し,血管抵抗を変えて血圧を変化させる働きがあります.この血管平滑筋細胞のタイプ(表現型*1)が,正常血管では収縮力の大きい"収縮型"であるのに対し,病的な血管では収縮力の小さい"合成型"になるとの報告もあります.
今回の研究では,偏光を利用してこの細胞の収縮力を評価できる方法を開発しました.機械工学では,透明な物体内の力の状態を,複屈折量による位相差(リタデーション)で評価する光弾性法(詳細は【研究の内容・成果】を参照)という手法があります.今回の研究では,この光弾性法を細胞に適用しました.収縮薬・弛緩薬を投与した細胞のリタデーションがそれぞれ増加・減少し,従来の収縮力計測法で計測した細胞収縮力が大きいほど,同一の細胞で計測したリタデーションが大きくなったことから,本手法で収縮力の増減を評価できたことを示しました.さらに,血管平滑筋細胞のリタデーションは,合成型よりも収縮型で大きくなり,細胞の表現型を容易に評価できる手法になる可能性も示しました.
本手法は,ガラス上に播種した細胞を顕微鏡で観察する容易な手法であり,細胞シートなど細胞が隣同士接着しているような状態でも計測可能,従来法である牽引力顕微鏡法*2とは異なり基板弾性率に依らない,などの利点を有しています.
なお、この研究成果は、2019年3月8日(英国時間)に学術誌Scientific Reportsにオンライン掲載されました("Photoelasticity-based evaluation of cellular contractile force for phenotypic discrimination of vascular smooth muscle cells").
研究の背景
細胞は,内部に筋肉のような線維構造があります.これを収縮させることで細胞自身の形態を変化させて移動したり,周囲の物質を引っ張ったりしています.特に,大動脈に存在する血管平滑筋細胞は,細胞の長軸方向を血管円周方向に配向させており,自らを収縮させて血管径を調節し,血管抵抗を変えて血圧を変化させる働きがあります.この血管平滑筋細胞のタイプ(表現型*1)は,正常な血管組織内では収縮力の大きい"収縮型"であるのに対し,動脈硬化1)や高血圧2),大動脈瘤3)などでは収縮力の小さい"合成型"であるとの報告もあり,収縮力は細胞の健康を示す指標になると考えられます.
従来,細胞の収縮力を測定する方法としては,かたさが既知の柔らかい基板上に細胞を播種し,基板の変形量から力を計測する「牽引力顕微鏡法*2」が代表的でした.しかし,この手法では基板の変形量を計測するために,基板が十分に柔らかい必要があり,生体内環境のかたさでは変形量が小さく計測が困難でした.また,基板の変形量から力を計測するため,細胞が隣同士接着した状態では互いに逆方向に基板を引っ張り合い変形がなくなると,力の計測が困難でした.さらに,ビーズをゲルに埋めるなど煩雑な手法が必要でした.
1) Kocher, O. & Gabbiani, G. Cytoskeletal features of normal and atheromatous human arterial smooth muscle cells. Hum. Pathol. 17, 875-880 (1986).
2) Régent, A. et al. Proteomic analysis of vascular smooth muscle cells in physiological condition and in pulmonary arterial hypertension: Toward contractile versus synthetic phenotypes. Proteomics 16, 2637-2649 (2016).
3) Nakajima, N., Nagahiro, S., Sano, T., Satomi, J. & Satoh, K. Phenotypic modulation of smooth muscle cells in human cerebral aneurysmal walls. Acta Neuropathol. (Berl). 100, 475-480 (2000).
研究の内容・成果
機械工学では,透明な物体内の力の状態を測る光弾性法という手法が古くからあります.通常,光は様々な方向に振動面を持ちますが,直線偏光は1方向にのみ振動面をもつ光です.屈折率が方向によって異なる「複屈折物質*3」に対し,振動方向が異なる2つの直線偏光を入射するときを考えます.屈折率とは真空中の光速に対する物質内での光速の比であるため,物質内での2偏光は通過速度が異なります.即ち,屈折率の大きい方向の偏光は物質中を遅く進み,屈折率の小さい方向の偏光が速く進みます.このため,複屈折物質から出射した2偏光間には位相差(リタデーション)が生じます(図2).物体が引っ張られて複屈折物質となった場合,この引張力が大きいほどリタデーションが大きくなるため,リタデーションで力の大きさを評価することができます.
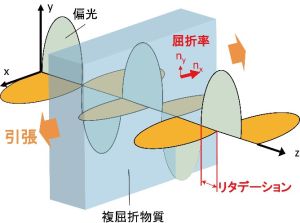
図2.屈折物質で生じるリタデーション.引張によりx方向は屈折率が大きくなるため,xz面内に振動面を持つ偏光 (オレンジ) は,物質中を遅く進む.一方,yz面内に振動面を持つ偏光 (薄緑) は,比較的速く進む.したがって,物質からの出射光では両者に位相差(リタデーション)が生じる.
今回の研究では,この光弾性法を細胞に適用し,細胞の収縮力がリタデーションで評価できるかを検討しました.まず,収縮薬・弛緩薬を投与すると,リタデーションがそれぞれ増加・減少しました(図3).次に,従来法の収縮力計測法である牽引力顕微鏡法と本法のリタデーション計測を同一細胞で実施したところ,両者には有意な相関があり,個々の細胞の収縮力の大小傾向が従来法と本法で同じとなりました.以上より,細胞収縮力の増減を評価できたことを示しました.また,血管平滑筋細胞の表現型の変化が評価可能かを調べるため,より合成型とされる継代数*4の大きい細胞と,より収縮型とされる継代数の小さい細胞のリタデーションを計測しました.その結果,収縮型のリタデーションは合成型よりも有意に高値となり,細胞の表現型を簡単に評価できる手法になる可能性も示しました.
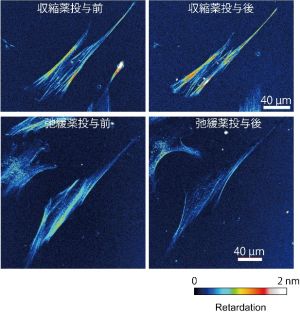
図3.収縮薬 (Calyculin A) と弛緩薬 (Y-27632) の投与前(左)と投与50分後(右)における血管平滑筋細胞のリタデーション像
社会的な意義
本法の収縮力評価法では,ガラス面に培養した細胞の収縮力を容易に評価できることから,血管平滑筋細胞の収縮力の変化を容易にとらえることができます.血管平滑筋細胞は,動脈硬化や高血圧,大動脈瘤部位で表現型が"合成型"であり,正常血管では"収縮型"であるとの報告から,細胞への薬効を調べるような創薬開発用ツールなどに応用されることを期待します.また,近年では外力が生体に作用し,細胞がその外力により応答を変化させることが知られており,そのメカニズムが解明されるようになってきております.そのような解明のためにも有用な手法になると考えられます.
今後の展望
実際の病変部の収縮力評価等、組織での評価法などが開発されることが期待されます.また,リタデーションで収縮力が評価できるメカニズムの解明や,収縮力の定量評価が必要です.
用語解説
*1 表現型
細胞は環境等により,タンパク質の発現の種類や量を変え,性質や機能を変えるが,この性質が示された形態.血管平滑筋細胞では,タンパク質合成や細胞増殖性が向上する合成型と,収縮能が向上する収縮型がある.
*2 牽引力顕微鏡法
細胞が発生する収縮力を計測する方法.細胞をゲル等の柔らかい基板上に播種し,細胞が発生する収縮力で基板が変形する「牽引力」を計測する方法である.かたさが既知の基板に蛍光ビーズ等のマーカを埋め込み,マーカの移動量から変位を計測し,基板かたさを考慮することで,基板に生じる応力(単位面積当たりの力)を計測する.この牽引力は細胞の収縮力と釣り合っているため,細胞の収縮力が計測できることになる.
*3 複屈折物質
屈折率が方向によって異なる物質.複数の屈折率がある物質.
*4 継代数
実験室で培養皿を用いて細胞を育てる場合,時間が経つと細胞が増殖して,次第に培養皿底面を満たすように増殖する.そこで,細胞を底面からはがす試薬などを用い,密度を薄くして新しい培養皿に移し替えることを行う.この作業を継代と呼び,継代した回数を継代数という.
論文情報
論文名:Photoelasticity-based evaluation of cellular contractile force for phenotypic discrimination of vascular smooth muscle cells
著者名:Shukei Sugita, Eri Mizutani, Masatoshi Hozaki, Masanori Nakamura, and Takeo Matsumoto
掲載雑誌名:Scientific Reports
公表日:2019/3/8 10 a.m. (UK time)
: 10.1038/s41598-019-40578-7
お問い合わせ先
研究に関すること
名古屋工業大学 大学院工学研究科
電気・機械工学専攻 准教授 杉田 修啓
TEL: 052-735-7125
E-mail: sugita.shukei[at]nitech.ac.jp
広報に関すること
名古屋工業大学 企画広報課
Tel: 052-735-5647
E-mail: pr[at]adm.nitech.ac.jp
*それぞれ[at]を@に置換してください。
マイクロ波特異反応場を利用することにより原子レベルで表面制御された可視光応答性酸化チタン光触媒の開発に成功 ―特異な化学表面構造を持つ機能性金属酸化物の新たな合成手法に道拓く― 電場による磁石極性の反転に成功 ―次世代低消費電力磁気メモリー実現の道拓く―

