フッ素化合物を持続可能な資源へ ― C-F結合を切断し、スチレンを二官能基化する新技術 ―
News&Topics
カテゴリ:プレスリリース|2025年9月24日掲載
発表のポイント
〇 有機フッ素化合物(酸フッ化物)のC-F結合を銅触媒で活性化し、スチレン類の二官能基化に成功
〇 最大99%の収率で46種類の有用分子を合成。医薬品や材料開発に幅広く応用可能。
〇 フッ素化合物の新たな活用法を開拓し、資源循環や環境問題解決に向けた基盤技術として期待。
概要
炭素―フッ素(C-F)結合は、炭素がつくる化学結合の中で最も強固であり、有機フッ素化合物はその高い安定性を活かして、現代社会の幅広い分野で利用されています。しかし、この安定性は同時に「分解されにくい」という特徴をもち、環境問題の一因ともなっています。とりわけPFAS(*1)は、その代表例として広く知られています。
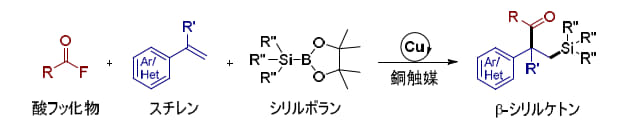
名古屋工業大学の趙正宇助教(生命・応用化学類)、周軍特任助教(研究当時:生命・応用化学類)、落合世舟氏(工学専攻生命・物質化学プログラム2年)、井川創太氏(研究当時:工学専攻生命・応用化学系プログラム2年)、柴田哲男教授(生命・応用化学類)らの研究グループは、有機フッ素化合物の一種である酸フッ化物(OECD(*2)定義上PFASには含まれません)のC-F結合を、銅触媒とシリルボランを用いて切断し、スチレン類を官能基選択的に二官能基化(*3)する新たな技術を開発しました(図1)。スチレンは、芳香族炭化水素の一種で、プラスチックや合成ゴムといった工業材料の原料として広く用いられています。本研究で確立された変換技術は、有機フッ素化合物の新たな活用法を切り拓くと同時に、材料合成の発展にも貢献する有用な成果といえます。
本研究成果は、国際学術誌 Chemical Science のオンライン速報版に、2025年9月10日付で掲載されました。
研究の背景
フッ素原子は、17族第2周期に属するハロゲン元素であり、水素に匹敵する小さな原子半径と、全元素中で最も高い電気陰性度を特徴としています。このため、炭素とフッ素が形成するC-F結合は非常に強固で、有機フッ素化合物は高い熱的安定性を示します。その安定性は「保存性」や「機能性」の観点から優れており、最終製品としてだけでなく、物質合成のための基礎原料や合成素子(*4)としても高い利用価値を持っています。したがって、有機フッ素化合物のC-F結合を起点とした官能基変換、すなわちC-F結合活性化反応は、多様な分子を自在に構築できる魅力的な技術として注目されています。
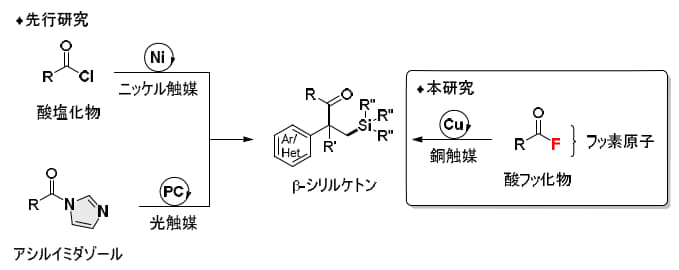
柴田研究室ではこれまで、多彩な有機フッ素化合物を対象としたC-F結合活性化法を開発してきました(*5)。今回注目したのは、カルボン酸誘導体の一つである酸フッ化物です。酸フッ化物はC-F結合に由来する高い安定性を有する一方で、同類の酸塩化物や酸臭化物に比べて反応性が乏しく、利用にはC-F結合の選択的な活性化が不可欠でした(*6)。
本研究では、この酸フッ化物をアシル源とし、スチレン類との二官能基化反応によってβ-シリルケトン(*7)を合成することに取り組みました。有機ケイ素化合物は炭素-ケイ素(C-Si)結合を持ち、医薬品や農薬、エラストマーなど身近な製品に広く使われています。また、C-Si結合を起点とする官能基変換法も多く知られており、特にβ-シリルケトン骨格は天然物合成や創薬研究において重要な中間体として期待されています。たとえば、β-シリルケトンは「スチレン類+シリルボラン+酸塩化物」の三成分を組み合わせることで合成可能ですが、酸塩化物は高反応性ゆえに水や熱に不安定という問題がありました。その改良法としてアシルイミダゾールを利用する方法も開発されましたが、合成法が限定的という課題が残されていました。
そこで本研究では、安定性・多様性・調製の容易さを兼ね備えた酸フッ化物を用いる新しい手法を開発しました。本反応は安価で市販入手可能な銅触媒とホスフィン配位子を用いるシンプルな触媒系で進行し、幅広い酸フッ化物、スチレン類、シリルボランに適用可能であることが示されました。この反応は、複数の基質を一挙に結合させる高効率な多成分連結反応であり、今後、創薬研究に資する有力なプラットフォーム技術として大いに期待されます(図2)。
研究の内容
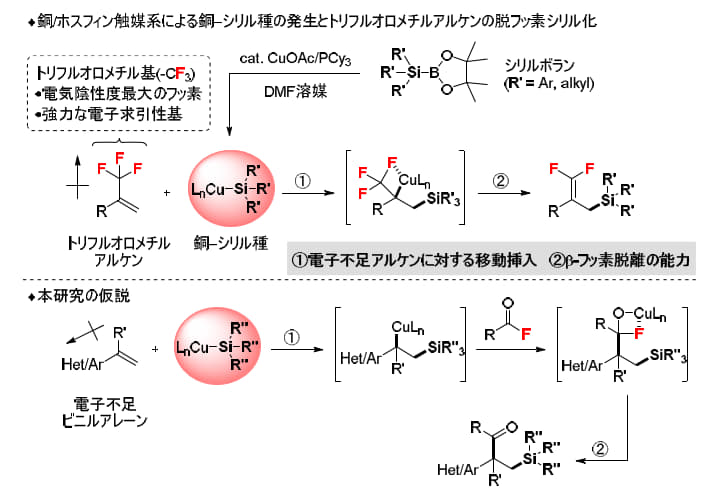
本研究の鍵となるのは、酢酸銅(CuOAc)、トリシクロヘキシルホスフィン(PCy₃)、N,N-ジメチルホルムアミド(DMF)溶媒を組み合わせた反応系です。研究グループはこれまでに、この触媒系にシリルボランを加えることで、銅-シリル活性種が効率的に生成し、電子不足のトリフルオロメチルアルケンと反応して「移動挿入-β-フッ素脱離」を伴う脱フッ素シリル化反応が円滑に進行することを明らかにしてきました。具体的には、まず電子不足アルケンに対する移動挿入が起こり、その後にβ-フッ素脱離が続く一連の過程がスムーズに進むことを確認しています。この知見に基づき、本研究では酸フッ化物・電子不足スチレン・シリルボランの三成分を組み合わせる新しい反応設計を行い、多様なβ-シリルケトン骨格を構築することを目指しました(図3)。
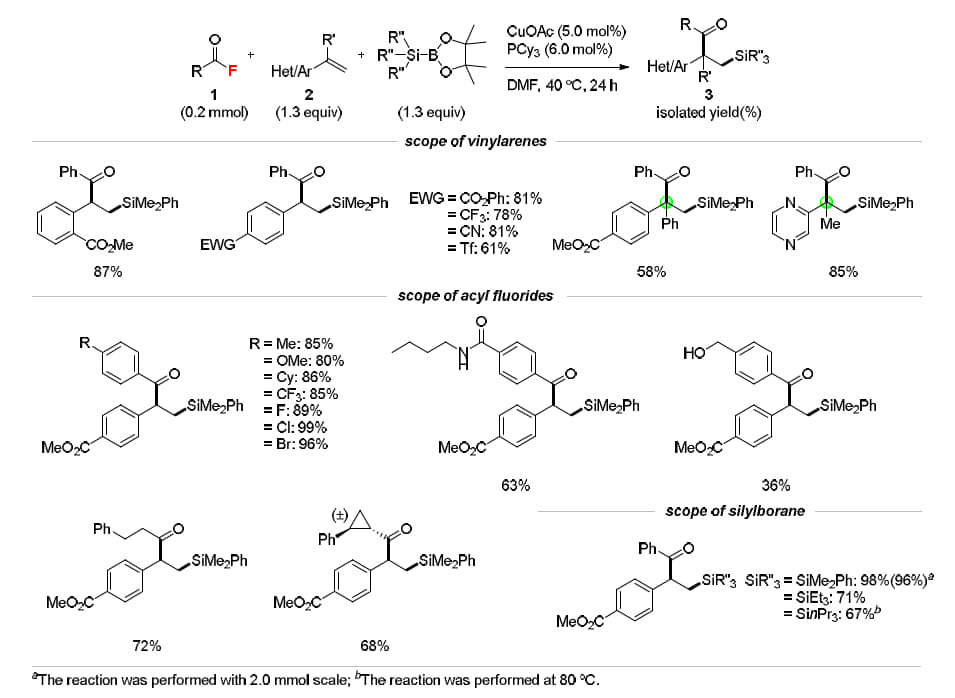
先行研究の知見を踏まえ、遷移金属触媒や配位子、溶媒の慎重なスクリーニングを行った結果、触媒量のCuOAcとPCy₃、そしてDMF溶媒の組み合わせが最も効果的であることが明らかになりました。具体的には、出発原料である酸フッ化物に対し、1.3当量のスチレンとシリルボラン試薬(PhMe₂Si-Bpin)を用い、反応温度40℃、反応時間24時間という条件で、所望のβ-シリルケトンを96%の単離収率で得ることに成功しました。さらに、この最適条件をもとに多様な基質を検討したところ、優れた官能基耐性を示し、最大99%の単離収率での生成が確認されました。その結果、生物活性分子を含む合計46種類のβ-シリルケトンの合成に成功しています。加えて、本反応はスケールアップにも対応可能であり、工業規模の反応装置への展開が十分に期待できることも示されました(図4)。
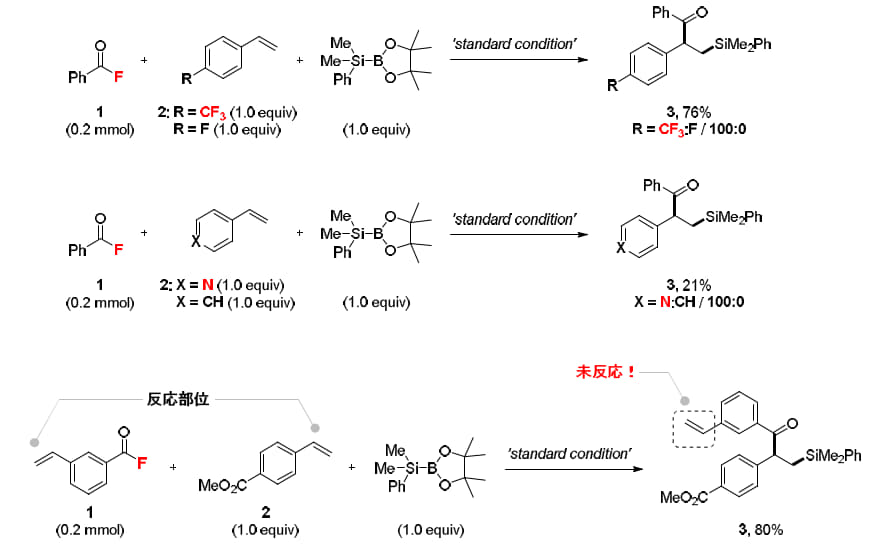
本反応の大きな特長は、電子不足スチレン類に対する高い選択性です。対照実験として、電子状態の異なる2種類のスチレン類を混合して反応を行ったところ、電子不足のスチレンに対してのみ二官能基化が優先的に進行し、対応する生成物を高選択的に得られることが明らかになりました。この優れた化学選択性を活用することで、複数の反応部位を持つ基質を用いた場合でも、副反応を起こすことなく、目的とするβ-シリルケトンを特異的かつ効率的に合成できることを実証しました(図5)。
反応機構の解明
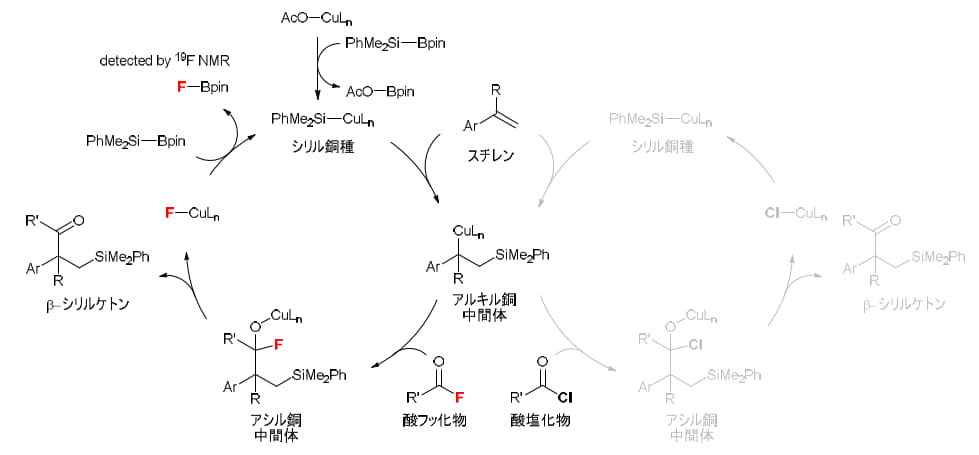
本研究では、得られた知見に基づいて反応機構を検討し、図6に示す触媒サイクルを提案しました。まず、CuOAc/PCy₃とシリルボラン(PhMe₂Si-Bpin)の間でσ結合メタセシスが起こり、活性種であるシリル銅(I)種が生成します。次に、このシリル銅種が電子不足スチレンの二重結合に移動挿入を起こし、アルキル銅中間体が形成されます。続いて、この中間体は酸フッ化物と反応し、銅がフッ素との親和性を示すことでC-F結合の切断が効率的に進行し、アシル銅中間体が得られます。この段階では、PCy₃配位子が中間体を安定化させ、反応を円滑に進める重要な役割を果たしています。さらに、ここからβ-フッ素脱離が起こり、目的のβ-シリルケトンが生成されると同時に、Cu(I)-F種が形成されます。このCu(I)-F種は再びシリルボランとσ結合メタセシスを起こし、シリル銅種が再生して触媒サイクルが完結します。副生成物として生成するF-Bpinは、実際に¹⁹F NMRによって確認されており、この経路を裏付けています。
また、本反応で酸フッ化物が特に優れた反応性を示す理由も明らかになりました。第一に、酸フッ化物のC-F結合は極性が高いため、酸塩化物のC-Cl結合に比べて銅による酸化的付加や求核置換が進みやすい点。第二に、生成するCu-F種はシリルボランと反応して容易に活性シリル銅種へ戻りますが、Cu-Cl種は再活性化が進みにくいため触媒サイクルが滞りやすい点です。
社会的な意義と今後の展望
今回見出された反応は、安定性と反応性を兼ね備え、多様な構造設計が可能な酸フッ化物を利用できる点、さらにスチレンの微細な電子状態の違いを見極め、高度に選択的な変換を実現できる点に大きな特長があります。これにより、有機フッ素化合物という安定かつ環境的課題を抱える分子群を、新しい機能性分子や医薬・材料の中間体へと積極的に転換できる道が拓かれました。特に、創薬や高機能材料の開発では、分子骨格の微妙な改変が性能に直結するため、本反応のもつ精緻な選択性と応用範囲の広さは強力なツールとなります。さらに、本反応はシンプルな触媒系で高収率かつスケールアップ可能であり、産業応用にも直結する実用性の高い技術です。これまで「安定すぎて扱いにくい」とされてきた有機フッ素化合物を、逆に持続可能な資源として有効活用する基盤技術となることが期待されます。
今後は、この技術を応用して医薬品合成、機能性材料開発、さらにはフッ素資源循環の推進へと展開していくことを目指しています。今回の成果は、学術的意義にとどまらず、環境課題の克服と新産業の創出につながる可能性を秘めた重要な一歩です。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 CREST研究領域「分解・劣化・安定化の精密材料科学」(研究総括:高原淳(九州大学))における研究課題「フッ素循環社会を実現するフッ素材料の精密分解」(研究代表者:柴田哲男)(課題番号JPMJCR21L1)、元島栖二博士 (CMC総合研究所)の支援を受けて実施しました。
論文情報
論文名: Chemoselective Cu-catalyzed acylsilylation of vinyl arenes using silylboronates and acyl fluorides
著者名: Zhengyu Zhao, Jun Zhou, Seishu Ochiai, Sota Ikawa, Norio Shibata*
*責任著者
掲載誌: Chemical Science
公表日: 2025年9月10日
DOI: 10.1039/D5SC05220C
URL: https://pubs.rsc.org/en/content/articlelanding/2025/sc/d5sc05220c
用語解説
(*1)PFAS
有機フッ素化合物の一群で、難分解性が国際的に問題視されている物質群。
(*2)OECD
経済協力開発機構。PFASの構造定義を提示している機関のひとつ。
(*3)二官能基化
ひとつの分子に対して、官能基を一挙に2つ導入する反応のこと。
(*4)合成素子
一般に、有機合成反応に用いる材料や原料のこと。
(*5)
「PFASからPTFEまでの室温分解に成功 ―金属ナトリウム分散体によるフッ素資源循環技術を開発―」(2025年7月22日)
「フルオロプラスチックの室温分解と再利用に成功 ―高い安全性と持続可能性を両立したフッ素資源循環に貢献―」(2025年6月30日)
「脂肪族フッ化物を用いたクロスカップリング反応 ―PFAS分解に向けた新たな道を開拓―」(2024年10月4日)
「全炭素四級立体中心の合成手法を開発 ―フッ素循環社会に向けた新しい合成技術―」(2024年3月5日)
「フッ素化合物とアミンとの脱フッ素化クロスカップリング反応 ―SDGsを指向した芳香族アミンの合成―」(2023年4月5日)
「遷移金属触媒不要のクロスカップリング反応を実現 ―SDGsを指向した新しい医薬品材料合成技術―」(2023年3月24日)
「フッ素化合物からフッ素のみを除去し分子変換する手法を開発 ― 環境破壊物質から医薬品や電子材料などへの再利用に期待 ―」(2021年6月21日)
「含フッ素医薬品を用いる分子変換新技術を開拓:新しい医薬品の創出に期待」(2018年10月22日)
(*6)
「環境負荷を低減したカルボン酸フロリドおよびペプチド合成 ―メカノケミカルにより迅速・無触媒反応を実現―」(2024年2月19日)
「安全にフッ化アシルを製造する新ツールを開発 ― 医農薬品・電子材料開発への利用を加速 ―」(2020年5月11日)
(*7)β-シリルケトン
ケトン(カルボニル化合物)のβ位にC‒Si結合を有する有機化合物の構造。
お問い合わせ先
研究に関すること
名古屋工業大学 生命・応用化学類
教授 柴田 哲男
TEL: 052-735-7543
E-mail: nozshiba[at]nitech.ac.jp
名古屋工業大学 生命・応用化学類
助教 趙正宇
TEL: 052-735-5234
E-mail: cho.seiu[at]nitech.ac.jp
広報に関すること
名古屋工業大学 企画広報課
TEL: 052-735-5647
E-mail: pr[at]adm.nitech.ac.jp
*[at]を@に置換してください。
ARTFUL CAMPUS 2026 未来共創 ~音楽×工学×美術―この力が交わるとき、未来の表現が生まれる~ 可視光で切り開く新しいホウ素化学 ~アミンボラン錯体の合成とクロスカップリング反応への応用による持続可能な有機合成技術の開拓~

